
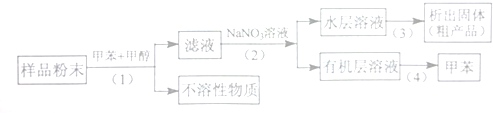
分析 (1)目前淡化海水的方法有多种,如:蒸留法、反渗透法、水合物法、溶剂萃取法和冰冻法;
(2)吹出Br2,用SO2吸收,发生氧化还原反应生成硫酸和HBr;Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3中Br由0降低为-1,由0升高为+5价,可知吸收3mol溴转移5mol电子;
(3)步骤(1)是分离固液混合物,其操作为过滤,步骤(2)分离互不相溶的液体混合物,需进行分液,要用到分液漏斗;步骤(3)是从溶液中得到固体,操作为蒸发,需要蒸发皿;步骤(4)是从有机化合物中,利用沸点不同采取蒸馏得到甲苯,以此来解答.
解答 解:(1)海水淡化的两种方法为蒸留法、反渗透法,故答案为:蒸留法;反渗透法;
(2)吹出Br2,用SO2吸收,发生氧化还原反应生成硫酸和HBr,离子反应为Br2+SO2+2H2O═4H++SO42-+2Br-,Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3中Br由0降低为-1,由0升高为+5价,可知吸收3mol溴转移5mol电子,则吸收1mol Br2时,转移电子的物质的量为$\frac{5}{3}$mol,
故答案为:Br2+SO2+2H2O═4H++SO42-+2Br-;$\frac{5}{3}$;
(3)A.步骤(1)是分离固液混合物,其操作为过滤,需要过滤装置,故A正确;
B.步骤(2)分离互不相溶的液体混合物,需进行分液,要用到分液漏斗,故B正确;
C.步骤(3)是从溶液中得到固体,操作为蒸发,需要蒸发皿,故C错误;
D.步骤(4)是从有机化合物中,利用沸点不同采取蒸馏得到甲苯,需要蒸馏装置,故D正确.
故选C.
点评 本题考查海水资源利用及分离提纯的实验,为高频考点,涉及氧化还原反应及分离提纯流程分析,侧重于学生的分析能力和实验能力的考查,注意合成流程中物质的性质及分离方法是解答本题的关键,注重实验操作和分离方法的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| B. | 乙醇、苯酚均能与NaOH溶液发生反应 | |
| C. | 乙醛、葡萄糖与新制的Cu(OH)2悬浊液共热,都产生红色沉淀 | |
| D. | 用饱和Na2CO3溶液能区分乙酸乙酯、乙醇和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(×10-4 mol/L) | 10 | 4.05 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)(×10-3 mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 该反应转化较快,具有现实意义 | |
| B. | 催化转化器在冬季时对废气转化的效率比夏季更高 | |
| C. | 在该温度下,反应的平衡常数K=10000 | |
| D. | 2 s末的平均反应速率为v(NO)=3.75×10-4 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
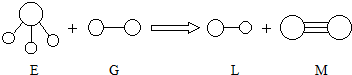
| A. | G是最活泼的非金属单质 | B. | L分子中有共价键 | ||
| C. | E能使紫色石蕊试液变蓝色 | D. | M化学性质很活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 服进肠胃的药剂根本不会直接进入人的膀胱中,Cu(OH)2悬浊液无法与葡萄糖作用 | |
| B. | 所用药剂具有毒性(含重金属元素Cu)和强腐蚀性(含NaOH),不能内服 | |
| C. | 该同学设计是正确的,但由于体温达不到令Cu(OH)2悬浊液与葡萄糖反应的温度,故检验不会成功 | |
| D. | 由于人们吃入的淀粉在体内也能水解成葡萄糖,会干扰检验的现象,检验应空腹进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 Fe(NO3)2溶液:H+、Al3+、SO42-、Cl-可以大量共存 | |
| B. | 0.1mol•L-1氨水:K+、Na+、NO3-、AlO2-可以大量共存 | |
| C. | 向(CH3COO)2Ba溶液中加入硫酸发生反应的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| D. | 已知K${\;}_{{a}_{1}}$(H2CO3)>Ka(HClO)>K${\;}_{{a}_{2}}$(H2CO3),向NaClO溶液中通入少量的CO2,发生反应的离子方程式为:CO2+2ClO-+H2O═CO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电池工作时,MnO2失去电子 | |
| B. | 电池工作时,电子由锌经外电路流向MnO2 | |
| C. | 从反应方程式来看,不使用氢氧化钾,也不影响电流大小 | |
| D. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
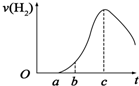 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )| A. | 2.7gAl与足量的该硫酸反应可得到标准状况下的H2 3.36L | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L | |
| C. | 配制200 mL 4.6 mol•L-1的稀硫酸需该硫酸50 mL | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com