
【题目】
(1)营养平衡、合理用药是保证人体健康和生活质量的重要途径。
①下列物质中,不能为人体提供能量的是_______(填字母)。
a.蛋白质 b.纤维素 c.油脂
②当出现外伤感染时,医生会建议使用以下常用药物中的______(填字母)。
a.复方氢氧化铝片 b.阿司匹林 c.盘尼西林
③食品添加剂亚硝酸钠的外观像食盐并有咸味,它不但是防腐剂,还具有抗氧化作用。亚硝酸钠属于____(填字母)。但亚硝酸钠会与肉类的蛋白质反应,生成一种致癌化合物——亚硝胺。所以不可长期或大量进食腌制类肉类。
a.调味剂 b.着色剂 c.发色剂
(2)积极保护生态环境可实现人与自然的和谐共处。
①向煤中加入石灰石,可有效减少_______的排放。
②向含有Hg2+的废水中加入____,可有效除去该重金属离子。
③下列物质能给水体杀菌消毒,又能使水体净化的是______(填字母)。
A.Na2FeO4(aq) B.KAl(SO4)2·12H2O C.Ca(ClO)2(aq) D.NaClO(aq)
④用二氧化碳生产化工产品,有利于二氧化碳的大量回收。某工业生产中利用CO2和C2H4及水蒸气在催化剂条件下合成乙酸(原子利用率100%),该反应的化学方程式为____________。
(3)材料是人类生存和发展的物质基础。
①汽车行驶在“超级高速公路”上行驶,自动收费系统会通过车载芯片对车辆进行自动收费。制取芯片的主要原料是_____ (填字母)。
a.硅 b.石墨 c.二氧化硅
②在下列材料中,属于复合材料的是____ (填字母)。
a.钢化玻璃 b.丁苯橡胶 c.氮化硅陶瓷 d.钢筋混凝土
③基础建设需要大量的水泥,水泥属于______(填字母),水泥的保质期通常只有三个月,不能长期保存的原因是_______________。
a.金属材料 b.无机非金属材料 c.有机高分子材料
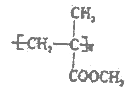
④有机玻璃是由有机物X加聚制得的热塑性塑料,为透明如玻璃状的无色固体,可用以制造航空窗玻璃、仪表盘、外科照明灯、装饰器和生活用品等,其结构简式如图所示。请写出X 的结构简式__________。
⑤太阳能电池需要用到高纯硅为原料。高温下焦炭和石英反应可以制得粗硅,该反应的方程式为__________________。
【答案】 b c c SO2 Na2S A 2CO2+2C2H4+2H2O![]() 3CH3COOH a d b 水泥的水硬性或水泥能吸收空气中的水分并与之发生化学反应 CH2=C(CH3)COOCH3 SiO2+2C
3CH3COOH a d b 水泥的水硬性或水泥能吸收空气中的水分并与之发生化学反应 CH2=C(CH3)COOCH3 SiO2+2C![]() Si+2CO↑
Si+2CO↑
【解析】(1)①糖类、油脂和蛋白质是人体常见的提供能量的物质,人体不能消化纤维素,故答案为:b;
②当出现外伤感染时,医生会建议使用消炎药,a.复方氢氧化铝片为抗酸药,错误;b.阿司匹林为解热镇痛药,错误;c.盘尼西林为消炎药,正确;故选c;
③亚硝酸钠属于发色剂,故选c;
(2)①向煤中加入石灰石作为脱硫剂,可以减少SO2的排放,故答案为:SO2;
②向含Hg2+的废水中加入Na2S以除去Hg2+,故答案为:Na2S;
③A.Na2FeO4(aq)具有强氧化性,能够杀菌消毒,还原后生成的铁离子水解生成氢氧化铁胶体,具有净水作用,正确;B.KAl(SO4)2·12H2O水解生成的氢氧化铝胶体,具有净水作用,但不能杀菌消毒,错误;C.Ca(ClO)2(aq) 具有强氧化性,能够杀菌消毒,但没有净水作用,错误;D.NaClO(aq) 具有强氧化性,能够杀菌消毒,但没有净水作用,错误;故选A;
④CO2和C2H4及水蒸气在催化剂条件下合成乙酸(原子利用率100%),反应的化学方程式为2CO2+2C2H4+2H2O![]() 3CH3COOH,故答案为:2CO2+2C2H4+2H2O
3CH3COOH,故答案为:2CO2+2C2H4+2H2O![]() 3CH3COOH;
3CH3COOH;
(3)①制取芯片的主要原料是硅,故答案为:a;
②a.钢化玻璃是无机非金属材料,错误;b.丁苯橡胶是有机高分子材料,错误;c.氮化硅陶瓷是无机非金属材料,错误;d.钢筋混凝土是钢材和混凝土的复合材料,正确;故选d;
③水泥的主要成分为硅酸盐,属于无机非金属材料,水泥能吸收空气中的水分并与之发生化学反应,不能长期保存,故答案为:b;水泥的水硬性或水泥能吸收空气中的水分并与之发生化学反应;
④有机玻璃( )是由有机物X加聚制得的热塑性塑料,X的结构简式为CH2=C(CH3)COOCH3,故答案为:CH2=C(CH3)COOCH3;
)是由有机物X加聚制得的热塑性塑料,X的结构简式为CH2=C(CH3)COOCH3,故答案为:CH2=C(CH3)COOCH3;
⑤高温下焦炭和石英反应可以制得粗硅,反应的方程式为SiO2+2C![]() Si+2CO↑,故答案为:SiO2+2C
Si+2CO↑,故答案为:SiO2+2C![]() Si+2CO↑。
Si+2CO↑。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】环境监测测定水中溶解氧的方法是:
①量取amL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1~2 mL浓硫酸(酸化,提供H+),使之生成I2,再用bmol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL。有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2S2O32-=2I-+S4O62-。
试回答:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少________________________。
(2)滴定操作时,左手控制滴定管,右手__________,眼睛要注视__________。
(3)滴定(I2和S2O32-反应)以淀粉为指示剂,终点时溶液由__________色变为__________色。
(4)水中溶解氧的计算式是__________(以g/L为单位)。
(5)测定时,滴定管经蒸馏水洗涤后即加滴定剂Na2S2O3溶液,导致测定结果__________(填“偏高”“偏低”或“无影响”,下同)。
(6)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下一定体积的HCl气体,将其溶于500mL的稀硫酸溶液中,假设溶液的体积不变化,向混合溶液中加入0.60mol/L的NaOH溶液50mL恰好呈中性。继续向呈中性的溶液中加入过量的氯化钡溶液,所的沉淀的质量为2.33g。
(1)生成沉淀的离子反应方程式:_______________________________。
(2)原硫酸溶液的浓度为:______________________________________。
(3)标准状况下HCl气体的体积为多少毫升?(写出计算过程)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的的是
选项 | 实验方案 | 实验目的 |
A |
| 验证FeCl3对H2O2分解反应有催化作用 |
B |
将NO2球浸泡在冰水和热水中 | 探究温度对平衡2NO2 |
C |
| 除去CO2气体中混有的SO2 |
D |
| 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硝酸的尾气中含有氮氧化物NO、(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。工业上常用Na2CO3溶液吸收法处理NOx。
已知:NO不能与Na2CO3溶液反应
NO+NO2+Na2CO3=2NaNO2+CO2 (I)2NO2+Na2CO3=NaNO2+NaNO3+CO2 (II)
将lmolNOx通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3-、NO2-两种离子的物质的量随x变化关系如图所示。下列说法正确的是

A. 当NOx被Na2CO3溶液完全吸收时,x的值可能是1.3
B. 用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出) 时,吸收液质量就增加44g,则NOx中的x值为1.875
C. 图中线段a表示NO3-离子的物质的量随x值变化的关系
D. 若用溶质质量分数为21.2%的Na2CO3溶液吸收,则需要Na2CO3溶液至少150g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2(g)+3H2(g)![]() 2NH3(g)已达到平衡状态的是
2NH3(g)已达到平衡状态的是
①1个N![]() N键断裂的同时,有3个H-H键断裂 ②1个N
N键断裂的同时,有3个H-H键断裂 ②1个N![]() N键断裂的同时,有6个N-H键断裂 ③其他条件不变时,混合气体平均相对分子质量不再改变 ④恒温恒容时,体系压强不再改变 ⑤NH3、N2、H2的体积分数都不再改变 ⑥恒温恒容时,混合气体的密度保持不变 ⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
N键断裂的同时,有6个N-H键断裂 ③其他条件不变时,混合气体平均相对分子质量不再改变 ④恒温恒容时,体系压强不再改变 ⑤NH3、N2、H2的体积分数都不再改变 ⑥恒温恒容时,混合气体的密度保持不变 ⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校研究性学习小组的同学进行了以下化学实验:将金属钙置于空气中燃烧,然后向所得固体产物中加入一定量蒸馏水,此过程中反应放出大量的热,并且放出有臭味的气体。
(1)甲同学提出:运用类比学习的思想,Ca与Mg位于同一主族,化学性质具有一定的相似性。请写出Ca在空气中燃烧发生反应的化学方程式_______________________________。
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧还应有CaO2生成,请写出燃烧后固体产物与水反应放出气体的化学方程式______________________________。丙同学提出用实验的方法探究放出臭味气体的成分:
(查阅资料)
1.CaO2遇水反应生成H2O2,H2O2可能会分解产生一定量的O3。
2.碘量法是最常用的臭氧测定方法,其原理为强氧化剂臭氧(O3)与碘化钾(KI)水溶液反应生成游离碘(I2),臭氧转化为氧气。反应式为O3+2KI+H2O===O2+I2+2KOH。
(提出假设)
假设1:该臭味气体只有NH3;
假设2:该臭味气体只有________;
假设3:该臭味气体含有________。
(设计方案 进行实验探究)
(3)该小组同学设计如下实验方案,并进行实验,验证上述假设。请完成相关的实验操作步骤、预期现象及结论(仪器自选)。
限选实验试剂:红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉-KI溶液、蒸馏水。
实验操作 | 预期现象与结论 |
取少量反应后固体于试管中,_____________ | ______________________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯二氧化硅可用下列流程制得.下列说法不正确的是
![]()
A. X可用作木材防火剂
B. 步骤Ⅱ的反应是Na2SiO3+H2SO4═H2SiO3(胶体)+ Na2SO4
C. 步骤Ⅱ中的稀硫酸可用CO2来代替
D. SiO2既能与盐酸反应,又能与氢氟酸反应,所以SiO2是两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NH4Cl和Ca(OH)2制取氨气,下图A和B是常用的气体发生装置。

(1)实验室制氨气时反应的化学方程式是______________________________________,应选用的装置是_____;若改用浓氨水和NaO固体制氨气时,应选取的装置是________。
(2)为了得到干燥的氨气,实验室常使用________做干燥剂(请从碱石灰、浓硫酸、氯化钠中选出一种物质)。
(3)实验室常用_______法收集氨气。在标准状况下,将盛满氨气的集气瓶倒置于水中(假设溶质全部在集气瓶内),则所得溶液的物质的量浓度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com