
| �� | �� | �� | |||
| �� | �� | �� | �� |
 ��
������ �ݵ��⻯�ﳣ����Ϊ���壬�������ʹʪ��ĺ�ɫʯ����ֽ������������Ϊ���������ΪNԪ�أ���ϸ�Ԫ�������ڱ��е����λ�ÿ�֪����ΪNaԪ�ء���ΪMgԪ�ء���ΪAlԪ�ء���ΪCԪ�ء���ΪOԪ�ء���ΪSԪ�أ��ݴ˽��Ԫ��������֪ʶ���
��� �⣺�ݵ��⻯�ﳣ����Ϊ���壬�������ʹʪ��ĺ�ɫʯ����ֽ������������Ϊ���������ΪNԪ�أ���ϸ�Ԫ�������ڱ��е����λ�ÿ�֪����ΪNaԪ�ء���ΪMgԪ�ء���ΪAlԪ�ء���ΪCԪ�ء���ΪOԪ�ء���ΪSԪ�أ�
��1����ΪCԪ�أ�ԭ������Ϊ6��λ�����ڱ��еڶ����� �ڢ�A�壬
�ʴ�Ϊ���ڶ����� �ڢ�A�壻
��2����ΪNaԪ�ء���ΪMgԪ�ء���ΪAlԪ�أ�ͬһ������ԭ������ԽС������Խǿ����Na�Ľ�������ǿ��NaԪ�ص�����������Ӧ��ˮ����ΪNaOH����������Ϊ���ӻ���������ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��3���٢ڢֱ�ΪNa��Mg��OԪ�أ����ӵĵ��Ӳ�Խ�࣬���Ӱ뾶Խ���Ӳ���ͬʱ���ӵĺ˵����Խ�����Ӱ뾶ԽС�������ּ����Ӱ뾶�ɴ�С��˳���ǣ�O2-��Na+��Mg2+��
�ʴ�Ϊ��O2-��Na+��Mg2+��
��4��ͨ����ӦCl2+H2S=S��+2HCl��֪Cl2�������Դ���S���ʣ���ClԪ�صķǽ����Խ�ǿ��
�ʴ�Ϊ��Cl2+H2S=S��+2HCl��
��5���ٺֱ͢�ΪNa��OԪ�أ�Na��O�γɵ�һ�ֻ�����A�к���һ��10��������һ��18���������û�����Ϊ�������ƣ���������Ϊ���ӻ�����仯ѧʽ�мȺ������Ӽ��ֺ��й��ۼ���
�ʴ�Ϊ�����ۼ������Ӽ���
��6����ΪOԪ�ء���ΪSԪ�أ������⻯��ֱ�ΪH2O��H2S������H2O���Ӽ�������������ȷ��Ӽ�������ǿ������H2O�ķе�ϸߣ�
�ʴ�Ϊ��H2O�� H2O���Ӽ�������������ȷ��Ӽ�������ǿ��
��7���١��۷ֱ��γɵ�����������Ӧ��ˮ����ֱ�ΪNaOH��Al��OH��3����������������������Ӧ����ƫ�����ƺ�ˮ�����߷�Ӧ�����ӷ���ʽΪ��OH-+Al��OH��3=AlO2-+2H2O��
�ʴ�Ϊ��OH-+Al��OH��3=AlO2-+2H2O��
���� ���⿼��λ�á��ϸ������ʹ�ϵ��Ӧ�ã���Ŀ�Ѷ��еȣ���ȷ�ƶϢ�ΪNԪ��Ϊ���ؼ���ע����������ԭ�ӽṹ��Ԫ�������ɡ�Ԫ�����ڱ��Ĺ�ϵ������������ѧ���ķ���������������������


 Ӧ�����������Ĵ���ѧ������ϵ�д�
Ӧ�����������Ĵ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | AlCl3��Һ�м��������İ�ˮ��Al3++3OH-�TAl��OH��3�� | |
| B�� | �������������ռ���Һ��Ӧ��Cl2+2OH-�TCl-+ClO-+H2O | |
| C�� | ͭ��ϡ���ᷴӦ��Cu+4H++2NO3-�TCu2++2NO2��+2H2O | |
| D�� | ������SO2ͨ��NaOH�У�SO2+2OH-�TSO32-+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͨ����ѧ�仯����ʵ��16O��18O֮���ת�� | |
| B�� | ��ΪH2O�ķе����H2S������Oԭ�ӵõ�����������Sԭ�� | |
| C�� | ij����������״̬���ܵ��磬�û�������һ�������Ӽ� | |
| D�� | ��ѧ�������ڷ���֮���ǿ�ҵ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Ԫ�� | �ṹ�����ʵ���Ϣ |
| A | �Ƕ������У���ϡ�������⣩ԭ�Ӱ뾶����Ԫ�� |
| B | B��Aͬ���ڣ�������������ˮ��������� |
| C | Ԫ�ص���̬�⻯�K������ˮ������������� |
| D | �Ǻ�ˮ�г��⡢��Ԫ���⺬������Ԫ�أ��䵥�ʻ���Ҳ������ˮ���������г��õ�����ɱ���� |
| E | ��̬ԭ�ӵ�M��ȫ������N��û�гɶԵ��ӣ�ֻ��һ��δ�ɶԵ��� |
 ����ԭ�Ӻ�����3��δ�ɶԵ��ӣ�������ߵĵ���Ϊ2p����ϵĵ��ӣ������������Σ�
����ԭ�Ӻ�����3��δ�ɶԵ��ӣ�������ߵĵ���Ϊ2p����ϵĵ��ӣ������������Σ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | S��ȼ����Ϊ297.23 kJ/mol | |
| B�� | �γ�1 mol SO2�Ļ�ѧ�����ͷŵ����������ڶ���1mol S��s����1mol O2��g���Ļ�ѧ�������յ������� | |
| C�� | S��g��+O2��g��=SO2��g���ų�������С��297.23 kJ | |
| D�� | 1mol SO2���������� 1mol S��s����1mol O2��g���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 400mL 1mol/Lϡ������Fe��ȫ��Ӧ����ԭ����ֻ��NO����ת�Ƶ��ӵ���ĿΪ0.3NA | |
| B�� | ����0.1 mol NH4+�İ�ˮ�У�����OH-����ĿΪ0.1 NA | |
| C�� | ��״̬�£�33.6 L�������к���1.5 NA����������� | |
| D�� | 30 g��������������Ļ������ȫȼ�գ�����O2�ķ�����ĿΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
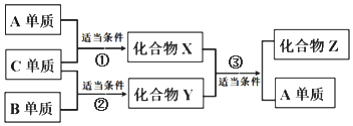 ԭ��������������Ķ�����Ԫ��A��B��C��D�ֱ�λ�ڲ�ͬ��������ֻ��һ�ֽ�����D�ĵ��ʿ�����ˮ�����û���Ӧ��������Һֻ��ʹ��̪��Ϊdz��ɫ��X��Y��Z����A��B��C��ɵĶ�Ԫ���������X����ΪҺ�壬��Z����������̼�����ϣ�����֮��������ת����ϵ�����٢�����Ϊ��ȼ����Ϊ���¡�����������˵������ȷ���ǣ�������
ԭ��������������Ķ�����Ԫ��A��B��C��D�ֱ�λ�ڲ�ͬ��������ֻ��һ�ֽ�����D�ĵ��ʿ�����ˮ�����û���Ӧ��������Һֻ��ʹ��̪��Ϊdz��ɫ��X��Y��Z����A��B��C��ɵĶ�Ԫ���������X����ΪҺ�壬��Z����������̼�����ϣ�����֮��������ת����ϵ�����٢�����Ϊ��ȼ����Ϊ���¡�����������˵������ȷ���ǣ�������| A�� | D�����Ż�������ĭ�������� | |
| B�� | ������Y��Z��Ϊ���������ձ�����Ҫ��Ⱦ�� | |
| C�� | ԭ��뾶��D��B��C��A | |
| D�� | ������W��ѧʽΪB2A4����һ��������W������X������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �÷�Ӧ�Ļ�ѧ����ʽΪ��CO2+H2$?_{����}^{����}$ CO+H2O | |
| B�� | ��������С�ݻ���ƽ�ⲻ�����ƶ���H2��Ũ��Ҳ���� | |
| C�� | �����¶ȣ��淴Ӧ���ʼ�С | |
| D�� | �÷�Ӧ�ķ�Ӧ��Ϊ��ֵ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com