
 如图为元紊周期表中短周期非金属元素,W原子最外层电子数是其电子层数的2倍,下列说法不正确的是( )
如图为元紊周期表中短周期非金属元素,W原子最外层电子数是其电子层数的2倍,下列说法不正确的是( )| A. | 原子半径Y>Z | B. | WZ2能使酸性高锰酸钾溶液褪色 | ||
| C. | X的氢化物比Y的氢化物稳定 | D. | W元素氧化物的水化物一定是强酸 |
分析 如图为元紊周期表中短周期非金属元素,W原子最外层电子数是其电子层数的2倍,W可能位于第二或第三周期,当W位于第二周期时,W最外层电子数为4,是C元素,碳族元素中C的原子序数最小,W不可能为W;W位于第三周期时,最外层电子数为6,则W为S,根据各元素在周期表中的相对位置可知Z为O、X为C、Y为Si元素,且满足四种元素都是非金属元素,据此结合元素周期律知识解答.
解答 解:如图为元紊周期表中短周期非金属元素,W原子最外层电子数是其电子层数的2倍,W可能位于第二或第三周期,当W位于第二周期时,W最外层电子数为4,是C元素,碳族元素中C的原子序数最小,W不可能为W;W位于第三周期时,最外层电子数为6,则W为S,根据各元素在周期表中的相对位置可知Z为O、X为C、Y为Si元素,且满足四种元素都是非金属元素,
A.原子的电子层越多,原子半径越大,Y的电子层数大于Z,则原子半径Y>Z,故A正确;
B.WZ2为SO2,二氧化硫具有还原性,能够酸性高锰酸钾溶液褪色,故B正确;
C.非金属性越强,氢化物的稳定性越强,非金属性X>Y,则X的氢化物比Y的氢化物稳定,故C正确;
D.W元素氧化物的水化物不一定是强酸,如亚硫酸为弱酸,故D错误;
故选D.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,根据题干信息正确推断W为解答关键,注意掌握元素周期表结构、元素周期律内容,试题有利于培养学生的分析能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4 | B. | NaNO2 | C. | FeCl3 | D. | HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
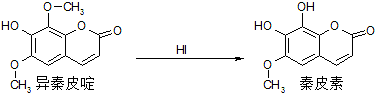 异嗪皮啶具有清热凉血,活血消斑,祛风通络等效,秦皮素具有抗痢疾杆菌功效,用于治疗儿童急性菌痢.它们在一定条件下有如图所示的转化关系.下列有关说法正确的是( )
异嗪皮啶具有清热凉血,活血消斑,祛风通络等效,秦皮素具有抗痢疾杆菌功效,用于治疗儿童急性菌痢.它们在一定条件下有如图所示的转化关系.下列有关说法正确的是( )| A. | 秦皮素的分子式为C10H10O5 | |
| B. | 异嗪皮啶与秦皮素均不能使酸性KMnO4溶液褪色 | |
| C. | 1mol异嗪皮啶最多可与3molNaOH反应 | |
| D. | 异嗪皮啶与秦皮素可用FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com