
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
 .
. 或
或
 .
. 分析 由元素在周期表的位置可知,①~⑩分别为H、C、N、O、Na、Mg、Al、S、Cl、As,
(1)元素⑩为As,⑦为Al,原子结构中有3个电子层、最外层电子数为3;
(2)同周期从左向右非金属性增强、金属性减弱,金属性越强,对应最高价氧化物对应的水化物的碱性越强;
(3)元素④氢化物为水或过氧化氢;
(4)由①、③、④三种元素形成的常见离子化合物为铵盐;
(5)⑥、⑨形成化合物为氯化镁,为离子化合物.
解答 解:由元素在周期表的位置可知,①~⑩分别为H、C、N、O、Na、Mg、Al、S、Cl、As,
(1)元素⑩为As,⑦为Al,原子结构中有3个电子层、最外层电子数为3,原子结构示意图为 ,故答案为:As;
,故答案为:As; ;
;
(2)同周期从左向右非金属性增强、金属性减弱,金属性越强,对应最高价氧化物对应的水化物的碱性越强,则从⑤到⑨元素中非金属性较强的元素是Cl,这些元素的最高价氧化物对应的水化物中碱性最强的是NaOH,故答案为:Cl; NaOH;
(3)元素④氢化物为水或过氧化氢,电子式为 或
或 ,故答案为:
,故答案为: 或
或 ;
;
(4)由①、③、④三种元素形成的常见离子化合物为铵盐,如NH4NO3或NH4NO2,故答案为:NH4NO3或NH4NO2;
(5)⑥、⑨形成化合物为氯化镁,为离子化合物,电子式表示形成过程为 ,
,
故答案为: .
.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识及化学用语的应用,题目难度不大.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHCO3俗名纯碱,可用作发酵粉 | B. | Mg(OH)2可用作治疗胃酸过多的药剂 | ||
| C. | CaCO3可用作高温材料 | D. | Na2O2可用作自来水的消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子式为C16H18O9 | |
| B. | 1mol咖啡鞣酸水解时可消耗8mol NaOH | |
| C. | 1mol 咖啡鞣酸最多可消耗Br2 6 mol | |
| D. | 能发生取代反应和加成反应,但不能消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 所有金属与所有非金属原子之间都能形成离子键 | |
| C. | 因为离子键是一种强相互作用,所以离子化合物均很难分解 | |
| D. | 含有离子键的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
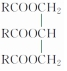 ”来表示,其中R为碳原子数目多于10的链烃基,可以相同也可以不同.分子式为C51H92O6的某油脂在稀硫酸中加热水解后得到A、B两种物质,若A的相对分子质量为92(已知:R1-CH═CH-R2$→_{H+}^{KMnO_{4}}$R1-COOH+R2-COOH),则
”来表示,其中R为碳原子数目多于10的链烃基,可以相同也可以不同.分子式为C51H92O6的某油脂在稀硫酸中加热水解后得到A、B两种物质,若A的相对分子质量为92(已知:R1-CH═CH-R2$→_{H+}^{KMnO_{4}}$R1-COOH+R2-COOH),则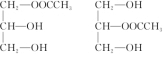 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. ,用电子式表示Y的形成过程
,用电子式表示Y的形成过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com