
【题目】呋喃(C4H4O)是生产抗流感药物磷酸奥司他韦(又名达菲)的原料之一,以玉米芯为原料制备呋喃及相关衍生物的一种工艺流程如下:
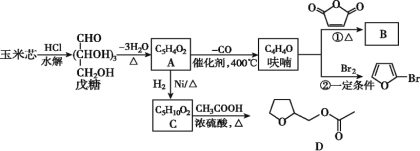
已知:①A可以发生银镜反应;②![]() +‖
+‖![]()
![]() 。
。
试回答下列问题:
(1)D的分子式为____。
(2)呋喃的结构简式为____;②的反应类型为______。
(3)A发生银镜反应的化学方程式为_____________。
(4)反应①在有机合成中具有重要意义,则B的结构简式为________。
(5)C的同分异构体中,含有“![]() ”结构的共有____种(不含立体异构),其中能发生银镜反应,且核磁共振氢谱中有2组吸收峰的有机物的结构简式为______。
”结构的共有____种(不含立体异构),其中能发生银镜反应,且核磁共振氢谱中有2组吸收峰的有机物的结构简式为______。
(6)参照上述合成路线,设计以环己烯和丙烯为原料制备![]() 的合成路线(无机试剂任选)。_____________________________________________________________
的合成路线(无机试剂任选)。_____________________________________________________________
【答案】C7H12O3 ![]() 取代反应
取代反应 ![]() +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
![]() +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O 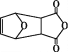 13
13 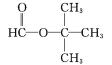
![]()
![]()
![]()
![]()
![]()
![]()
![]()
【解析】
根据逆向合成法的运用,由D的结构简式和C→D的转化关系,可得C的结构简式为![]() ,由C的结构简式、A的分子式以及已知信息①、A→C的转化关系可得,A的结构简式为
,由C的结构简式、A的分子式以及已知信息①、A→C的转化关系可得,A的结构简式为![]() ,可得呋喃的结构简式为
,可得呋喃的结构简式为![]() ,再根据已知信息②,呋喃与
,再根据已知信息②,呋喃与![]() 发生信息②的反应,可推知B的结构简式为
发生信息②的反应,可推知B的结构简式为 ,据此分析解答。
,据此分析解答。
(1)根据D的结构简式,节点为碳原子,每个碳原子形成4个共价键,不足键由氢原子补齐,分子式为C7H12O3;
(2)根据分析,呋喃的结构简式为![]() ;呋喃在一定条件下与溴单质发生取代反应生成
;呋喃在一定条件下与溴单质发生取代反应生成![]() ,则②的反应类型为取代反应;
,则②的反应类型为取代反应;
(3) A的结构简式为![]() ,发生银镜反应的化学方程式为
,发生银镜反应的化学方程式为![]() +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
![]() +2Ag↓+3NH3+H2O;
+2Ag↓+3NH3+H2O;
(4)根据分析,B的结构简式为 ;
;
(5)分子式符合C5H10O2且分子含有“![]() ”结构的有机化合物可能是羧酸,也可能是酯类物质,因-C4H9有4种结构,则C4H9-COOH有四种结构,C4H9-OOCH也有四种结构;C3H7-有两种结构,则CH3COO-C3H7与CH3OOC-C3H7分别有两种结构,CH3CH2OOC-CH2CH3只有一种结构,故C的同分异构体中,含有“
”结构的有机化合物可能是羧酸,也可能是酯类物质,因-C4H9有4种结构,则C4H9-COOH有四种结构,C4H9-OOCH也有四种结构;C3H7-有两种结构,则CH3COO-C3H7与CH3OOC-C3H7分别有两种结构,CH3CH2OOC-CH2CH3只有一种结构,故C的同分异构体中,含有“![]() ”结构的共有13种结构;其中能发生银镜反应,说明属于甲酸酯,且核磁共振氢谱中有2组吸收峰说明分子中只有2种不同环境的氢原子,则该有机物的结构简式为
”结构的共有13种结构;其中能发生银镜反应,说明属于甲酸酯,且核磁共振氢谱中有2组吸收峰说明分子中只有2种不同环境的氢原子,则该有机物的结构简式为 ;
;
(6)由环己烯和丙烯为原料制备![]() ,可由
,可由![]() 与Br2发生加成反应生成
与Br2发生加成反应生成![]() ,
,![]() 在氢氧化钠醇溶液加热条件下发生消去生成
在氢氧化钠醇溶液加热条件下发生消去生成![]() ,
,![]() 与丙烯(CH2=CHCH3)发生信息②的反应生成目标产物
与丙烯(CH2=CHCH3)发生信息②的反应生成目标产物![]() ,则合成路线为:
,则合成路线为:![]()
![]()
![]()
![]()
![]()
![]()
![]() 。
。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】依据事实,书写下列热化学方程式:
(1)在25℃、101kPa时,1mol C与1mol水蒸气反应生成1mol CO和1mol H2,吸热131.5kJ:______________________。此反应的反应类型_________。
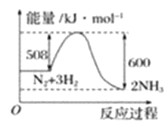
(2)根据如图写出热化学方程式____;此反应为____反应(放热或吸热);此反应的活化能____千焦。
(3)已知稀溶液中,1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应中和热的热化学方程式________________________。
(4)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJ·mol–1
2SO3(g) ΔH=-196.6kJ·mol–1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0kJ·mol–1
2NO2(g) ΔH=-113.0kJ·mol–1
请写出NO2与SO2反应生成SO3和NO的热化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
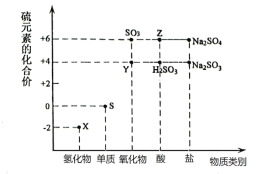
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有___(填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中还原剂与氧化剂的物质的量之比为___。
(3)检验物质Y的方法是___。
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为___。
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是___(填代号)。
a.Na2S+S b.SO2+Na2SO4 c.Na2SO3+S d.Na2SO3+Na2SO4 e.SO2+ Na2S2+Na2CO3
(6)已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL0.05 mol·L-1的Na2SO3溶液与20mL0.02mol·L-1的K2Cr2O7溶液恰好完全反应时,Cr元素在还原产物中的化合价为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O (方程式中H为+1价,O为-2价)下列说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O (方程式中H为+1价,O为-2价)下列说法正确的是( )
A.KClO3在反应中失电子B.ClO2是氧化产物
C.H2C2O4在反应中被氧化D.1 molKClO3参加反应有2mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列实验装置图,按要求作答:

(1)装置中c、d、e的名称分别为_________
(2)分离下列物质,需要在哪套装置中进行?
I.干燥H2,可采用______(填装置序号)装置
II.除去食盐溶液中的水,可采用_____(填装置序号)装置
III. 淡化食盐水,可采用___(填装貿序号)装置
IV.实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可采用____(填装置序号)装置除去Ca(OH)2溶液中悬浮的CaCO3微粒
V.分离碘水中的碘应先选择装置_____(填装置序号),进行______和____操作,再用装置____(填装置序号)进行______操作。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,某研究小组以氢氧化钠固体、浓氨水、干冰等为原料制备氨基甲酸铵的实验装置如图所示,其主要反应的原理为2NH3(g)+CO2(g)NH2COONH4(s) ΔH<0。
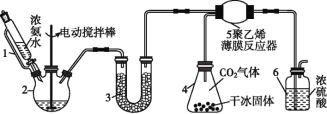
(1)仪器3中盛装的固体是____,其作用是________________。
(2)仪器6的一个作用是控制原料气按化学计量数充分反应,若反应初期观察到装置内浓硫酸中产生气泡,则应该___(填“加快”“减慢”或“不改变” )产生氨的速率。
(3)另一种制备氨基甲酸铵的反应装置(液态石蜡和CCl4均充当惰性介质)如图所示。
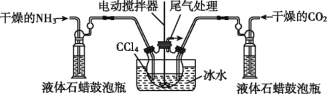
①液态石蜡鼓泡瓶的作用是________________________。
②当CCl4液体中产生较多晶体悬浮物时,立即停止反应,过滤分离得到粗产品,为了将所得粗产品干燥,可采取的方法是___(填字母)。
A.蒸馏 B.真空微热烘干 C.高压加热烘干
(4)制得的氨基甲酸铵中可能含有碳酸氢铵、碳酸铵中的一种或两种杂质(不考虑氨基甲酸铵与水的反应)。
①设计方案进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
实验步骤 | 预期现象和结论 |
步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解 | 得到无色溶液 |
步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,则证明固体中不含碳酸铵 |
步骤3:向试管中继续加入____________ | _____________,则证明固体中含有碳酸氢铵 |
②根据①的结论,取15.8 g氨基甲酸铵样品,用足量氢氧化钡溶液充分处理后,过滤洗涤、干燥,测得沉淀的质量为1.97 g。则样品中氨基甲酸铵的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某同学对相应反应的离子方程式所作的评价,其中对应的评价合理的是( )
编号 | 化学反应 | 离子方程式 | 评价 |
A | 把MgSO4溶液滴入Ba(OH)2溶液 | Mg2++2OH-=Mg(OH)2↓ | 正确 |
B | 氧化铜与稀盐酸反应 | CuO+2H+=Cu2++H2O | 错误,不反应 |
C | 向FeCl2溶液中通入氯气 | Fe2++Cl2=Fe3++2Cl- | 错误,电荷不守恒 |
D | 向沸水滴入饱和氯化 铁溶液 | Fe3++3H2O | 正确 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列叙述正确的是( )
为阿伏加德罗常数的值。下列叙述正确的是( )
A.![]() 乙烷分子中含有的共价键数目为
乙烷分子中含有的共价键数目为![]()
B.![]() 完全溶于水转移的电子数为
完全溶于水转移的电子数为![]()
C.标准状况下,![]() 含有的原子数为
含有的原子数为![]()
D.![]() 乙烯和丙烯的混合物中含有的质子数为
乙烯和丙烯的混合物中含有的质子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 人们最早先根据味道来获得朴素的酸、碱概念:一切有酸味的物质都是酸,一切有涩味的物质都是碱。
B. 波义耳基于指示剂变色来分辨酸碱:酸一定能使石蕊变红,碱一定能使石蕊变蓝。
C. 地球上最大规模的化学反应是植物的光合作用,人类利用氮肥的最有效的反应是合成氨反应。
D. 酸碱质子理论:凡是能给出![]() 的物质就是酸,凡是能结合
的物质就是酸,凡是能结合![]() 的物质就是碱,适用水溶液,也适用非水溶液或无水条件。
的物质就是碱,适用水溶液,也适用非水溶液或无水条件。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com