
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-,据此判断,以下叙述错误的是( )
NH4++NH2-,据此判断,以下叙述错误的是( )
A.一定温度下液氨中c(NH4+)·c(NH2-)是一个常数
B.液氨中含有NH3、NH4+、NH2-等粒子
C.只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
D.液氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-)
【答案】D
【解析】
A.液氨中c(NH4+)与c(NH2-)的乘积只与温度有关;
B.可逆反应中的各种微粒都共存;
C.只要不破坏氨分子的电离平衡,液氨中存在c(NH4+)=c(NH2-);
D.液氨与水的电离相似,为微弱电离,所以液氨中主要存在NH3。
A.液氨中c(NH4+)与c(NH2-)的乘积只与温度有关,与溶液的浓度无关,所以只要温度一定,液氨中c(NH4+)与c(NH2-)的乘积为定值,A正确;
B.液氨电离中存在电离平衡,所以液氨中含有 NH3、NH4+、NH2-粒子,B正确;
C.根据2NH3![]() NH4++NH2-可知,液氨电离出NH4+、NH2-的个数比为1:1,所以只要不加入其它物质,液氨中c(NH4+)与c(NH2-)总是相等,C正确;
NH4++NH2-可知,液氨电离出NH4+、NH2-的个数比为1:1,所以只要不加入其它物质,液氨中c(NH4+)与c(NH2-)总是相等,C正确;
D.液氨与水的电离相似,为微弱电离,所以液氨中主要存在NH3,所以液氨的电离达到平衡时,c(NH3)>c(NH4+)=c(NH2-),D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】室温下,用0.100 0 mol·L-1NaOH溶液分别滴定体积均为20.00 mL的盐酸和醋酸溶液,滴定曲线如右图。下列说法正确的是
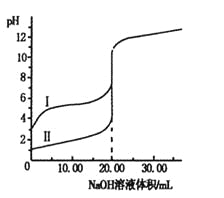
A.I、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.盐酸和醋酸的浓度均为0.100 0 mol·L-1
C.pH=7时,两种酸所消耗NaOH溶液的体积相等
D.V(NaOH)=20.00mL时,c(Cl一)=c(CH3COO一)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量 | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式![]() 将化学计量数填于空白处
将化学计量数填于空白处![]()
______ ![]() ______
______ ![]() ______
______ ![]() ______
______ ![]() ______
______ ![]() ______
______ ![]()
(2)已知:![]() 某学生测定食用精制盐的碘含量,其步骤为:
某学生测定食用精制盐的碘含量,其步骤为:
![]() 准确称取12.7g食盐,加适量蒸馏水使其完全溶解;
准确称取12.7g食盐,加适量蒸馏水使其完全溶解;
![]() 用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
![]() 以淀粉为指示剂,逐滴加入物质的量浓度为6.0×10-4molL-1的Na2S2O2溶液20.0mL,恰好反应完全.
以淀粉为指示剂,逐滴加入物质的量浓度为6.0×10-4molL-1的Na2S2O2溶液20.0mL,恰好反应完全.
![]() 判断c中反应恰好完全依据的现象是 ______ .
判断c中反应恰好完全依据的现象是 ______ .
![]() 根据以上实验和包装袋说明,所测精制盐的碘含量是 ______mg/kg.
根据以上实验和包装袋说明,所测精制盐的碘含量是 ______mg/kg.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的合成线路如下:

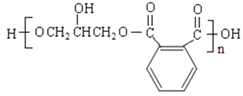
已知:RCH2CH=CH2![]()
![]()
(1)C的名称是_____________________。
(2)B中含有的官能团是_____________________。
(3)反应①、③的有机反应类型分别_______________________。
(4)下列说法正确的是__________(填字母编号)。
a.1 mol E与足量的新制Cu(OH)2溶液反应能生成2mol Cu2O
b.F的核磁共振氢谱有4个峰,且峰面积比为1:1:1:1
c.可以用NaHCO3鉴别E和F
d.B分子不存在顺反异构
(5)写出反应③的化学方程式___________;
(6)写出反应⑤的化学方程式____________;
(7)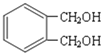 的同分异构体中同时符合下列条件的芳香族化合物共有__________种,其中苯环上一氯代物有两种的结构简式为_______。
的同分异构体中同时符合下列条件的芳香族化合物共有__________种,其中苯环上一氯代物有两种的结构简式为_______。
a.能发生消去反应b.能与过量浓溴水反应生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式书写错误的是( )
A.乙醇催化氧化制取乙醛:2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
B.苯与浓硫酸、浓硝酸的混合液共热制硝基苯:![]() +HNO3
+HNO3![]()
![]()
C.乙酸和乙醇发生反应生成乙酸乙酯:CH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
D.乙烯使溴的四氯化碳溶液褪色:CH2=CH2+Br2→CH2Br—CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称三盐,白色或微黄色粉末,稍带甜味、有毒。200℃以上开始失去结晶水,不溶于水及有机溶剂。可用作聚氯乙烯的热稳定剂。以100.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。
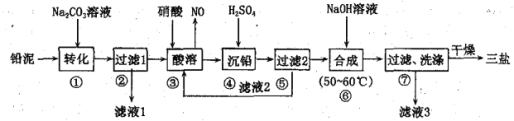
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。请回答下列问题
(1)步骤①转化的目的是将PbSO4转化为PbCO3,反应的离子方程式为___________________。
(2)滤液3中的主要溶质为_____________(填化学式)。
(3)步骤③酸溶时,铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为____________________。
(4)滤液2中可循环利用的溶质为___________(填化学式)。若步骤④沉铅后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO42-)为___________mol·L-1
(5)步骤⑥合成三盐的化学方程式为____________________________。若得到纯净干燥的三盐49.50 t,假设铅泥中的铅元素有80.00%转化为三盐,则铅泥中铅元素的质量分数为_____。[已知:三盐(3PbO·PbSO4·H2O)的相对分子质量为990,注意保留正确的有效数字]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示
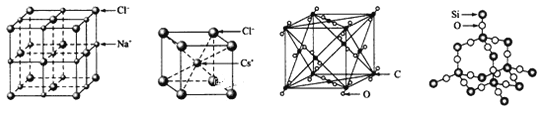
(1) 在NaCl的晶胞中,与Na+最近且等距的Na+有_____个,在NaCl的晶胞中有Na+_____个,Cl-____个
(2)在CsCl的晶胞中,Cs+与Cl-通过_________结合在一起。
(3) 1mol二氧化硅中有______mol硅氧键。
(4)设二氧化碳的晶胞密度为a g/cm3,写出二氧化碳的晶胞参数的表达式为____n m (用含NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制溴苯可用如图装置。回答下列问题:
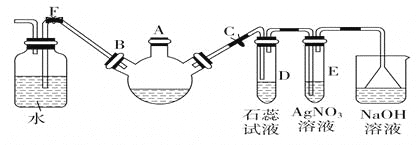
(1)关闭F夹,打开C夹,向装有少量苯的三口烧瓶的A口加少量溴,再加少量铁屑,塞住A口,则三口烧瓶中发生的有机化学反应方程式为_______________________。
(2)D试管内出现的现象为________________;E试管内出现的现象为________________。
(3)待三口烧瓶中仍有气泡冒出时打开F夹,关闭C夹,可看到的现象是_____________________。
(4)从溴苯中除去溴,用NaOH溶液处理后再洗涤,反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的短周期主族元素,R为过渡元素。Y的最高价氧化物的水化物是强酸,Z元素的基态原子中有2个未成对电子,基态W原子的价电子排布式为nsn-1npn-1,X与W为同主族元素。基态R原子的M能层全充满,核外有且仅有1个未成对电子。请回答下列问题:
(1)基态R原子核外价电子排布式为___。
(2)X、Y、Z三种元素的第一电离能由大到小的顺序为___(填元素符号)。
(3)元素Y的简单气态氢化物的沸点___(填“高于”或“低于”)元素X的简单气态氢化物的沸点,其主要原因是___;元素Y的简单气态氢化物中Y原子的杂化类型为___,元素X的简单气态氢化物分子的空间构型为___。
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为___(填序号)。
A.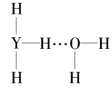 B.
B. 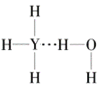 C.
C.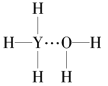 D.
D.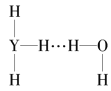
(5)R元素与Y元素形成的某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶胞的边长是acm,则该晶体的密度为___g·cm-3(用NA表示阿伏加德罗常数的值)。
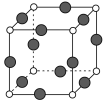
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com