
| A. | 该电池的工作环境是高温条件 | |
| B. | 作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原 | |
| C. | 该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等 | |
| D. | 该电池的总反应为C6H12O6+6O2$\frac{\underline{\;催化剂\;}}{\;}$6CO2+6H2O |
分析 A、该电池是燃料原电池,反应条件温和;
B、葡萄糖在反应中失去电子被氧化;
C、浓硫酸能和有机物发生脱水反应;
D、将正负极反应方程式相加即可得总反应方程式.
解答 解:A、该电池是燃料原电池,反应条件温和,所以不是高温条件,故A错误;
B、C元素的化合价升高,则葡萄糖在反应中失去电子被氧化,故B错误;
C、浓硫酸能和有机物发生脱水反应,电池的电解质溶液不能是浓硫酸,故C错误;
D、将正负极反应方程式相加即可得总反应方程式为:C6H12O6+6O2$\frac{\underline{\;催化剂\;}}{\;}$6CO2+6H2O,故D正确;
故选:D.
点评 本题考查化学电源新型电池,明确原电池原理解答本题的关键,题目难度中等.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
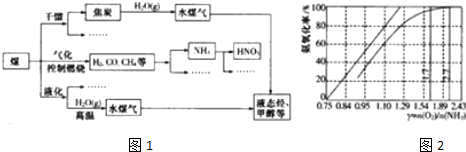
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
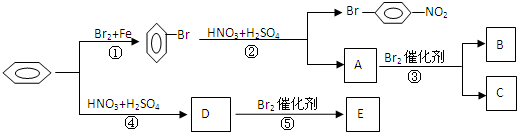
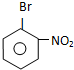 B
B 或
或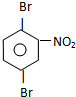 C
C 或
或 D
D E
E
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 | c(HCl)(mol•L-1) | 温度(℃) | 铁的状态 |  |
| 1 | 2.0 | 25 | 块状 | |
| 2 | 2.5 | 30 | 块状 | |
| 3 | 2.5 | 50 | 粉末状 | |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 3-4-2-1 | B. | 1-2-4-3 | C. | 4-3-2-1 | D. | 1-2-3-4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com