
【题目】下列变化不属于氧化还原反应的是
A. 钢铁的腐蚀 B. 食物腐败
C. 溶洞中钟乳石的形成 D. 白磷的自燃
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】实验室里要配制500mL0.2mol/L的硫酸钠溶液.实验步骤大致有:
(1)请填写下面空白处.
A.在天平上称出 g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解.
B.把得到的溶液小心地沿着玻璃棒注入 mL的容量瓶中.
C.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中.
D.继续向容量瓶中加蒸馏水至液面距刻度1~2cm处,改用 小心滴加蒸馏水至溶液凹液面底部与刻度线水平相切.
E.将瓶塞塞紧,充分摇匀.
F.将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶.
(2)下列情况会使所配溶液浓度偏高的是 (填序号).
①容量瓶用前内壁沾有水珠 ②没有进行上述的操作步骤C
③未冷却到室温就注入容量瓶定容 ④定容时,水加多了,用滴管吸出
⑤定容时,仰视容量瓶刻度线 ⑥定容时,俯视容量瓶刻度线
(3)如果实验室用98%的浓硫酸(密度为1.8gcm﹣3) 配制 3.6molL﹣1的稀硫酸150mL.计算所需浓硫酸的体积为 mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、碳都是重要的非金属元素,合理应用和处理碳和氮的化合物,在生产生活中有重要意义。
I.研究含氮污染物的治理是环保的一项重要工作。
T℃时,发生如下反应,3NO(g)+O3(g)![]() 3NO2(g),将0.6molNO和0.2molO3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图1所示。
3NO2(g),将0.6molNO和0.2molO3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图1所示。
①T℃时,反应3NO(g)+O3(g)![]() 3NO2(g)的平衡常数K=_____。
3NO2(g)的平衡常数K=_____。
②不能说明反应达到平衡状态的是______________。
A.气体颜色不再改变 B.气体的平均摩尔质量不再改变
C.气体的密度不再改变 D.单位时间内生成O3和NO2物质的量之比为1∶3

II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题。如图2所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1molNO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为aL(忽略导管中的气体体积)。
①若容器A中到达平衡所需时间ts,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)=_______。
②若打开K2,平衡后B容器的体积缩至0.4aL,则打开K2之前,气球B体积为__________L。
③若平衡后在A容器中再充入0.5molN2O4,则重新到达平衡后,平衡混合气中NO2的体积分数____(填“变大”“变小”或“不变”)。
Ⅲ.氮有不同价态的氧化物,如NO、N2O3、NO2等,它们在一定条件下可以相互转化。
(1)某温度下,在一体积可变的密闭容器中充入1mol N2O3,发生反应N2O3![]() NO2(g)+NO(g),达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图像如图所示,有关说法正确的是__________
NO2(g)+NO(g),达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图像如图所示,有关说法正确的是__________

A.t1时刻改变的条件是增大N2O3的浓度,同时减小NO2或NO的浓度
B.t1时刻改变条件后,平衡向正反应方向移动,N2O3的转化率增大
C.在t2时刻达到新的平衡后,NO2的百分含量不变
D.若t1时刻将容器的体积缩小至原容积的一半,则速率~时间图像与上图相同
(2)在1000K下,在某恒容容器中发生下列反应:2NO2(g)![]() 2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图所示。图中a点对应温度下.己知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图所示。图中a点对应温度下.己知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。


(3)对于反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中,k1、2是与反应及温度有关的常数。相应的速率-压强关系如图所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的两个点__________,理由是__________________________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中,k1、2是与反应及温度有关的常数。相应的速率-压强关系如图所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的两个点__________,理由是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①甲醛(HCHO)与葡萄糖化学性质相似,都具有还原性。②甲酸钙易溶于水。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下实验。
(1)在右图装置中进行实验,向a中加入0.5 mol·L-1CuSO4溶液50 mL和5 mol·L-1NaOH溶液100 mL,振荡,再加入40%的甲醛溶液50 mL,缓慢加热20分钟后冷却至室温。

①仪器a的名称是_____________;
②能说明甲醛具有还原性的实验现象是______________。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分,将装置A和如下图所示装置连接后进行实验。

依次连接的合理顺序为A→B→___→____→____→____→G,装置B的作用是_________。有H2的实验现象是_________________________。
(3)已知HCHO![]() HCOOH
HCOOH![]() H2CO3。设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。
H2CO3。设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。
(4)反应后a中有红色固体产生,为探究其组成,提出如下假设:
假设一:只有Cu2O。 假设二:只有Cu。
假设三:Cu2O和CuO 假设四:________________________ ;
假设_______明显不成立,理由是___________________________ 。
进行如下实验(以下每步均充分反应):

已知:Cu2O ![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
①锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为____________________;
②将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,氯水中部分含氯的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的百分数)与pH的关系如下图所示。下列叙述不正确的是( )
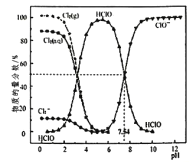
A. 新制氯水中持续通入SO2,pH不断变小,溶液颜色不断变浅
B. 新制的pH=l的氯水中,c(H+)>c(Cl3-)>c(HClO)
C. 25℃时,HC1O![]() H++ClO-的电离常数Ka的对数值为lgKa=-7.54
H++ClO-的电离常数Ka的对数值为lgKa=-7.54
D. pH=6的氯水中加入NaOH溶液,主要发生的离子反应方程式为Cl2+2OH-=ClO-+C1-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 向某无色溶液中加入AgNO3溶液有白色沉淀出现,则该溶液中一定含有Cl-
B. CO2属于酸性氧化物
C. 摩尔是国际基本物理量之一
D. 盐类物质一定含有金属离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.水分解和水汽化,克服的作用力一样
B.石英、金刚石、硫磺晶体类型不完全相同
C.离子化合物的熔点一定比共价化合物的高
D.NaCl稀溶液中,微粒间既存在离子键、共价键,也有分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我国科学家发明“可充电钠-二氧化碳电池”(如下图),放电时电池总反应为:4Na+3CO2=2Na2CO3+C。下列说法正确的是( )

A. 充电时,钠箔与外接电源的正极相连
B. 电池工作温度可能在200℃以上
C. 充电时,Na+向正极移动
D. 放电时,正极的电极反应为:4Na++3CO2+4e-=2Na2CO3+C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com