
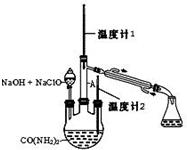
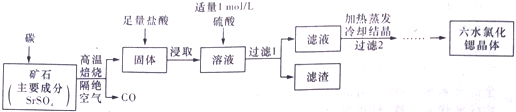
 水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:分析 (1)用天平称量氢氧化钠质量,用量筒量取水的体积,在烧杯中溶解,并用玻璃棒搅拌;
(2)氯气通入到盛有NaOH的锥形瓶中发生反应生成氯化钠、次氯酸钠和水;
(3)由N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl,可知水合肼(N2H4•H2O)具有还原性,易被次氯酸钠氧化;
(4)生成水合肼 (N2H4•H2O) 进行蒸馏分离,温度计1控制馏分水合肼蒸汽温度;
碘水具有强氧化性,能腐蚀碱式滴定管的橡胶;
N2H4•H2O完全反应,加入最后一滴碘溶液颜色不褪去,溶液呈微黄色且半分钟内不消失,说明滴定到达终点;
由N2H4+2I2=N2+4HI可知水合肼的物质的量,进而计算其质量分数.
解答 解:(1)用天平称量氢氧化钠质量,用量筒量取水的体积,在烧杯中溶解,并用玻璃棒搅拌,所需玻璃仪器除量筒外,还有烧杯、玻璃棒,
故答案为:BD;
(2)氯气通入到盛有NaOH的锥形瓶中发生反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O;
故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(3)由N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl,可知水合肼(N2H4•H2O)具有还原性,如果将 NaOH 和 NaClO 的混合溶液一次性加入三颈烧瓶,反应生成的水合肼会被次氯酸钠氧化,
故答案为:反应生成的水合肼会被次氯酸钠氧化;
(4)生成水合肼 (N2H4•H2O) 进行蒸馏分离,温度计1温度为118.5℃,判断 N2H4•H2O 开始蒸出,
碘单质具有氧化性,能腐蚀碱式滴定管的橡胶,则碘水应装在酸式滴定管中;
加入最后一滴碘溶液颜色不褪去,溶液呈微黄色且半分钟内不消失,说明滴定到达终点;
由N2H4+2I2=N2+4HI,可知250ml溶液中含有的物质的量=0.100mol/L×0.018L×$\frac{1}{2}$×$\frac{250mL}{10mL}$=0.0225mol,
水合肼(N2H4•H2O)的质量分数=$\frac{0.0225g×50g/mol}{1.250g}$×100%=90%,
故答案为:温度计1温度为118.5℃;酸式;溶液呈微黄色且半分钟内不消失;90%.
点评 本题考查物质制备实验,涉及溶液配制、物质含量测定、对操作的分析评价、滴定应用等,注意根据题目信息确定溶液添加顺序,较好的考查学生对实验原理的理解、知识迁移应用,难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:实验题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
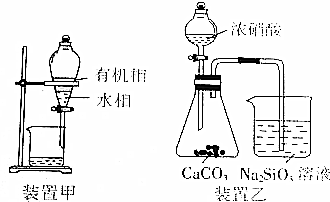
| A. | 制备Fe(OH)3胶体:向0.1mol•L-1FeCl3溶液中加适量NaOH溶液并煮沸片刻 | |
| B. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| C. | 用装置乙进行实验,证明酸性:硝酸>碳酸>硅酸 | |
| D. | 探讨改变浓度研究反应“2Fe3++2I-?2Fe2++I2”中Fe3+和Fe2+的相互转化:向3mL 0.05mol•L-1Fe2(SO4)3溶液中加入3 mL 0.01mol•L-1 KI溶液,将所得黄色溶液等分成三份,第一份加入数滴0.01 mol•L-1AgNO3溶液,第二份加入1mL0.01mol•L-1FeSO4溶液,第三份加1mL水,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定前,未用NaOH溶液对锥形瓶进行润洗 | |
| B. | 滴定过程中,有少量盐酸滴在锥形瓶外 | |
| C. | 盛装盐酸前,未对酸式滴定管进行润洗 | |
| D. | 滴定终点时,对酸式滴定管俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 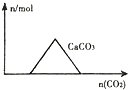 向Ca(OH)2和NaOH的混合溶液中通入CO2 | |
| B. | 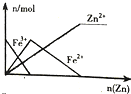 向FeCl3溶液中加入锌粉 | |
| C. |  向NaOH溶液中通入CO2 | |
| D. |  HCl与Cl2的混合通入NaOH溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
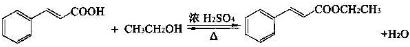
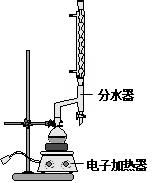
| 名称 | 相对分子质量 | 原色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 肉桂酸 | 148 | 白色晶体 | 300 | 1.2475 |
| 肉桂酸乙酯 | 176 | 无色油状液体 | 271.5 | 1.0491 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热后固体发黑 | B. | 坩埚沾有受热不分解的杂质 | ||
| C. | 加热时有少量晶体溅出 | D. | 晶体中混有受热不分解的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同物质的量浓度的Na2Y和NaHY溶液,前者的pH大于后者 | |
| B. | NaHY的溶液中,离子浓度大小顺序为:c(Na+)>c(Y-)>c(HY-)>c(OH-)>c(H+) | |
| C. | HY-的水解离子方程式为:HY-+H2O?Y-+H3O+ | |
| D. | 在Na2Y、NaHY、H2Y的溶液中,阴离子的种类不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com