
(1)Fe2(SO4)3水溶液呈________性,原因是(用离子方程式表示) ;
实验室在配制Fe2 (SO4)3溶液时,需要加入________来抑制水解。
(2)泡沫灭火器中装有Al2(SO4)3溶液、NaHCO3溶液及起泡剂。写出使用时发生反应的离子方程式:_____________________________________________________。
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | C | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是(双选)( )
A.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH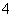
B.将Fe(OH)2溶于过量的稀硝酸:Fe(OH)2+2H+===Fe2++2H2O
C.用NaClO溶液吸收过量的SO2:ClO-+SO2+H2O===SO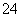 +Cl-+2H+
+Cl-+2H+
D.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
将1 mol冰醋酸加入到一定量的蒸馏水中最终得到1 L溶液。下列各项中,表征已达到电离平衡状态的是( )
A.醋酸的浓度达到1 mol·L-1
B.[H+]的浓度达到0.5 mol·L-1
C.[CH3COOH]、[CH3COO-]、[H+]均为0.5 mol·L-1
D.醋酸分子电离成离子的速率和离子重新结合成分子的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为:该溶液pH升高的原因是HCO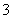 的水解程度增大,碱性增强。
的水解程度增大,碱性增强。
乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3的水解程度(填“大于”或“小于”)。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液 C. NaOH溶液 D.澄清石灰水
(2)将加热煮沸后的溶液冷却到10 ℃,若溶液的pH________8.3(填“高于”、“低于”或“等于”),则甲判断正确。
(3)查阅资料,发现NaHCO3固体的分解温度为150 ℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是_______________________________________________________________。
(4)关于NaHCO3饱和水溶液的表述正确的是_______________________。
a.c(Na+)=c(HCO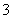 )+c(CO
)+c(CO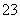 )+c(H2CO3)
)+c(H2CO3)
b.c(Na+)+c(H+)=c(HCO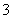 )+c(CO
)+c(CO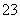 )+c(OH-)
)+c(OH-)
c.HCO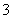 的电离程度大于HCO
的电离程度大于HCO 的水解程度
的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
实验测得常温下0.1 mol/L某一元酸(HA)溶液的pH不等于1,0.1 mol/L某一元碱(BOH)溶液里:c(H+)/c(OH-)=10-12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是( )
A.c(B+)=c(A-)>c(OH-)>c(H+) B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(B+)+c(H+)=c(A-)+c(OH-) D.c(B+)>c(A-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子中,每个离子都能影响水的电离平衡的一组是( )
A.Zn2+、Ag+、HCO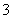 、Cl-、PO
、Cl-、PO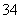 、SO
、SO B.Fe3+、Br-、Al3+、H+、CO
B.Fe3+、Br-、Al3+、H+、CO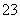 、H2PO
、H2PO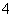
C.Ag+、SO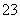 、SiO
、SiO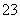 、Fe2+、S2- D.Fe2+、ClO-、NO
、Fe2+、S2- D.Fe2+、ClO-、NO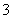 、HS-、Cu2+、HSO
、HS-、Cu2+、HSO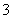
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中,粒子的物质的量浓度关系正确的是( )
A.0.1 mol·L-1的CH3COONa溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.0.1 mol·L-1的Na2CO3溶液中:c(OH-)=c(HCO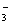 )+c(H+)+c(H2CO3)
)+c(H+)+c(H2CO3)
C.0.1 mol·L-1的NH4Cl溶液中:C(Cl-)>C(NH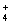 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.c(NH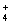 )相等的(NH4)2SO4溶液、NH4HSO4溶液、(NH4)2CO3溶液、NH4Cl溶液:
)相等的(NH4)2SO4溶液、NH4HSO4溶液、(NH4)2CO3溶液、NH4Cl溶液:
c< c<c(NH4HSO4)<c(NH4Cl)
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应有广泛应用。
(1)我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为S+2KNO3+3C===K2S+3CO2↑+N2↑。
上述反应中,如1.5 mol还原剂________(填“得到”或“失去”)________ mol电子,则生成________ g还原产物。
(2)铝热法是常用的金属冶炼方法之一。
已知:4Al(s)+3O2(g)===2Al2O3(s)
ΔH1=-3 352 kJ·mol-1
Mn(s)+O2(g)===MnO2(s) ΔH2=-521 kJ·mol-1
Al与MnO2反应冶炼金属Mn的热化学方程式是________________。
(3)高温电解技术能高效实现CO2(g)+H2O(g)===CO(g)+H2(g)+O2(g),工作原理示意图如下:
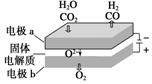
①电极b发生________(填“氧化”或“还原”)反应;
②CO2在电极a放电的反应式是__________________。
(4)黑色沉淀CuS、Cu2S放入浓硫酸中加热一段时间后,沉淀完全溶解,其中CuS溶解的化学方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上将氨气和空气的混合气体通过铂—铑合金网发生氨氧化反应,若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为( )
A.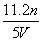 B.
B.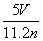
C.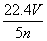 D.
D.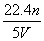
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com