
 式________________________;&科&(3)E具有不稳定性,因此实验室中保存E的方法是 ;
式________________________;&科&(3)E具有不稳定性,因此实验室中保存E的方法是 ; 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
| A.碘酸钾可氧化氯化钠 | B.只用淀粉就能检验碘盐中的碘酸钾 |
| C.高温会导致碘的损失 | D.该碘盐中碘酸钾含量约为34~84mg/kg |
 (2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI + 3H2O KIO3 + 3H2↑。则阳极材料为 。
(2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI + 3H2O KIO3 + 3H2↑。则阳极材料为 。 K2SO4+ I2+ H2O
K2SO4+ I2+ H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.8 mol | B.2.6 mol | C.2.4 mol | D.0.8 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
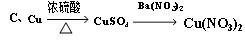
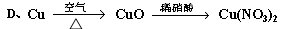
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 混合气体在标准状况下的体积为5.6L。请回答:
混合气体在标准状况下的体积为5.6L。请回答: 浓度。
浓度。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 学方程式为 ;
学方程式为 ;
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
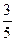 ,则混合气体中N2与NO2的体积比是
,则混合气体中N2与NO2的体积比是| A.2:3 | B.3:2 | C.3:5 | D.5:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com