
| 选项 | 实验操作 | 实验现象 | 解释与结论 |
| A | 向某溶液中加入BaCl2溶液 | 有白色沉淀产生 | 生成了难溶于水的BaSO4,该溶液中一定含有SO42- |
| B | 向少量AgNO3溶液中滴加适量NaCl溶液,再滴加适量稀NaI溶液 | 开始有白色沉淀生成,后有黄色沉淀生成 | Ksp(AgI)<Ksp(AgCl) |
| C | 向苯中滴入少量浓溴水,振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色 | 苯和溴水发生取代反应,使溴水褪色 |
| D | 向蔗糖中加入浓硫酸 | 变黑,放热,体积膨胀,放出刺激性气体 | 浓硫酸具有吸水性和强氧化性,反应中生成C、SO2和CO2等 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.可能生成AgCl沉淀;
B.开始有白色沉淀生成,后有黄色沉淀生成,说明AgI的溶度积较小,易生成;
C.苯和溴水不反应;
D.反应中浓硫酸表现出脱水性和氧化性.
解答 解:A.硝酸具有强氧化性,如溶液中含有SO32-,能被氧化为SO42-,也不能排除生成AgCl沉淀,应先加盐酸酸化,如无沉淀,再加入氯化钡观察,故A错误;
B.开始有白色沉淀生成,后有黄色沉淀生成,说明Ksp(AgI)<Ksp(AgCl),易生成AgI沉淀,故B正确;
C.苯和溴水不反应,溶液分层,上层呈橙红色,下层几乎无色,是由于溴溶于苯的原因,故C错误;
D.蔗糖变黑,反应中浓硫酸表现出脱水性,生成二氧化硫、二氧化碳,浓硫酸表现氧化性,故D错误.
故选B.
点评 本题考查元素化合物知识的综合理解和运用,侧重于物质的性质等实验方案的评价,注意把握相关物质的性质,为解答该类题目的关键,有利于学习良好的科学素养的培养,题目难度中等.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | DHA是从深海鱼油中提取的不饱和程度很高的脂肪酸,名称为二十二碳六烯酸,其甘油酯的分子式可能为C69H98O6 | |
| B. | 等物质的量的乙烯、乙醇、丙烯酸分别充分燃烧,所耗用氧气的量相等 | |
| C. | 由青蒿素( )合成双氢青蒿素( )合成双氢青蒿素(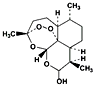 )的反应属于加成反应 )的反应属于加成反应 | |
| D. | 按系统命名法,化合物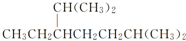 的名称为2,6二甲基5乙基庚烷 的名称为2,6二甲基5乙基庚烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用乙烯为原料生成环氧乙烷:2CH2=CH2+02$\stackrel{Ag}{→}$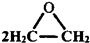 | |
| B. | 用铁氰化钾溶液检验 Fe2+:3Fe2++2[Fe(CN)6]3-=Fe2[Fe(CN)6]3↓ | |
| C. | NH4HS03溶液中加入足量的KOH溶液NH4++0H-=NH3•H2O | |
| D. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+S02+H20=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNaHSO4固体中含有的阳离子数目为0.1NA | |
| B. | 常温常压下,3.2gN2H4中含有的极性共价键数目为0.1NA | |
| C. | 25℃时,pH=12的Ba(OH)2溶液中含OH-的数目为0.01NA | |
| D. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
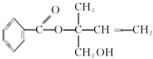
| A. | X的分子式为C12H16O3 | |
| B. | 可用酸性高锰酸钾溶液区分苯和X | |
| C. | 若单键可以旋转,有机物X中一定在同一平面上的碳原子数为8 | |
| D. | 在Ni作催化剂的条件下,1 molX最多只能与1molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
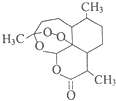 青蒿素(结构简式如图)是一种白色针状固体,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”.中国女科学家屠呦呦凭借用乙醚从青蒿中提取青蒿素获得2015年诺贝尔医学奖.下列关于青蒿素的说法不正确的是( )
青蒿素(结构简式如图)是一种白色针状固体,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”.中国女科学家屠呦呦凭借用乙醚从青蒿中提取青蒿素获得2015年诺贝尔医学奖.下列关于青蒿素的说法不正确的是( )| A. | 青蒿素分子中含有醚键和酯基等官能团 | |
| B. | 青蒿素在加热时能与NaOH的水溶液反应 | |
| C. | 青蒿素易溶于水、苯等溶剂 | |
| D. | 用乙醚从青蒿中提取青蒿素,用到了萃取原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 食用油反复加热会产生稠环芳香烃等有害物质 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 医用消毒酒精中乙醇的浓度为95% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
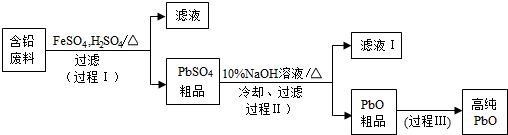
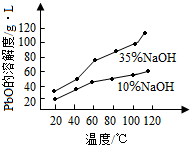
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com