
【题目】请按要求填空:
(1)Mg是第3周期元素,该周期部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1266 | 1534 | 183 |
①解释表中氟化物熔点差异的原因:
a._________________________________________________。
b.__________________________________。
②硅在一定条件下可以与Cl2反应生成SiCl4,试判断SiCl4的沸点比CCl4的________(填“高”或“低”),理由__________________________________。
(2)下列物质变化,只与范德华力有关的是_________
a.干冰熔化 b.乙酸汽化
c.石英熔融 d.HCONHCH3CH3溶于水
e.碘溶于四氯化碳
(3)C,N元素形成的新材料具有如下图所示结构, 该晶体的化学式为:_______________。该晶体硬度将超过目前世界上最硬的金刚石,其原因是________________________。

(4)FeCl3常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断FeCl3的晶体类型为_________________。
(5)氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大,熔点高、化学性质稳定。
①氮化硅的硬度________(“大于”或“小于”)氮化碳的硬度,原因是________________。
②下列物质熔化时所克服的微粒间的作用力与氮化硅熔化时所克服的微粒间的作用力相同的是_________。
a.单质I2和晶体硅 b.冰和干冰
c.碳化硅和二氧化硅 d.石墨和氧化镁
③已知氮化硅的晶体结构中,原子间都以单键相连,且氮原子与氮原子不直接相连、硅原子与硅原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式________。
(6)第ⅢA,ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。在GaN晶体中,每个Ga原子与______个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为________。在四大晶体类型中,GaN属于_______晶体。
【答案】NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点要高 因为Mg2+的半径小于Na+的半径,所以MgF2的离子键强度大于NaF的离子键强度,故MaF2的熔点大于NaF 高 SiCl4的相对分子质量比CCl4的大,范德华力大,因此沸点高 ae C3N4 氮原子半径小于碳原子半径,氮碳形成的共价键键长比碳碳键长短,键能更大 分子晶体 小于 硅原子半径大于碳原子半径,氮碳形成的共价键键长比氮硅键长要短,键能更大 c Si3N4 4 正四面体 原子
【解析】
(1)①NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2远比SiF4的熔点要高;因为Mg2+的半径小于Na+的半径,所以MgF2的离子键强度大于NaF的离子键强度,故MaF的熔点大于NaF。
②因为SiCI4和CCl4组成和结构相似,SiCl4的相对分子质量比CCl4的大,范德华力大,所以SiCl4的沸点比CCl4的高。答案:高;SiCl4的相对分子质量比CCl4的大,范德华力大,因此沸点高。
(2)a.干冰熔化只破坏分子间作用力;b.乙酸汽化破坏分子间作用力和分子间氢键;c.石英熔融破坏共价键;d.HCONHCH3CH3分子间不存在氢键,溶于水破坏范德华力;e碘溶于水只破坏范德华力,故只有ae符合要求。答案:ae。
(3) 该晶胞中含C原子数=8×1/8+4×1/2=3,N原子数为4,故该晶体化学式为C3N4。由于C—N键键长比C—C键键长短,键能大,所以金刚石硬度比C3N4硬于小。答案:C3N4 ;氮原子半径小于碳原子半径,氮碳形成的共价键键长比碳碳键长短,键能更大 。
(4)FeCl3溶沸点不高,且易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,说明FeCl3为分子晶体。答案:分子晶体。
(5) ①氮化硅和氮化碳均为原子晶体。氮化硅中C—Si键的键长比氮化碳中C—N键的键长长,键能小,所以氮化硅硬度比氮化碳小。答案:硅原子半径大于碳原子半径,氮碳形成的共价键键长比氮硅键长要短,键能更大。
②氮化硅是原子晶体,熔化时所克服的是共价键,a.单质I2是分子晶体,熔化时所克服的范德华力,晶体硅是原子晶体,熔化时所克服的是共价键;故a不符合;b.冰和干冰属于分子晶体,熔化只破坏分子间作用力,故b错误;c.碳化硅和二氧化硅属于原子晶体,熔化时所克服的是共价键,故c正确;d.石墨属于混合晶体,熔化时破坏分子间作用力和共价键;氧化镁是离子晶体,破坏离子键。答案:c。
③由题意知氮化硅晶体中每个Si原子连接4个N原子,每个N原子连接3个Si原子,Si和C原子均达到8电子稳定结构,其化学式为Si3N4。答案:Si3N4。
(6) GaN与单晶硅结构相似,所以每个Ga原子与4个N原子形成共价键,每个N原子与3个Ga原子形成共价键。与同一Ga原子相连的N原子构成的空间构型为正四面体结构,GaN与晶体硅都是原子晶体。答案:4;正四面体 ;原子。


科目:高中化学 来源: 题型:
【题目】铅蓄电池是生活中应用非常广泛的一种二次电池,关于其工作原理下列说法中正确的是
A. 放电时,负极电极溶解,电极质量减小
B. 放电时,电解质溶液中的H+向负极移动
C. 放电时,正极的反应式是: PbO2+SO42-+4H++2e-═PbSO4+2H2O
D. 充电时,当有20.7gPb生成时,转移的电子为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A. 制乙酸乙酯时,将乙醇注入浓硫酸中,冷却后加入乙酸
B. 向溴乙烷中滴加硝酸酸化的AgNO3溶液,以检验其中的溴元素
C. 用氢氧化钠溶液清洗盛过苯酚的试管
D. 在试管中加入2mL2%的CuSO4溶液,然后加入4至6滴10%的NaOH溶液振荡、再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是空间立体网状结构,如图所示:
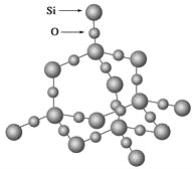
关于二氧化硅晶体的下列说法中,正确的是( )
A. 1 mol SiO2晶体中Si—O键为2 mol
B. 二氧化硅晶体的分子式是SiO2
C. 晶体中Si、O原子最外电子层都满足8电子结构
D. 晶体中最小环上的原子数为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是____(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料红氧化铁的工艺流程如下(部分操作和条件略):
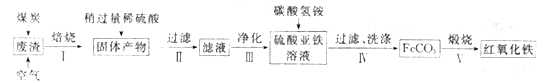
①在步骤Ⅰ中产生的有毒气体可能有_____________________。
②在步骤Ⅲ操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+ 沉淀完全,则溶液的pH为_________。(c(Al3+)≤1.0×10-5mol/L 视为Al3+沉淀完全)
③步骤Ⅳ中,生成FeCO3的离子方程式是____________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式______________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:__________________________________________________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应Ⅱ的离子方程式是____________________________________________。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN-,方案如下:

若试纸交蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,正确的是( )
A. 稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B. 稀硫酸与Ba(OH)2溶液混合:SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C. 稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3
D. 氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是( )

A. 电极b反应式是O2+4e-+2H2O=4OH-
B. 电解后乙装置d电极附近溶液的pH不变
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 甲中每消耗1mol SO2,乙装置中有1mol H+通过隔膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解饱和食盐水,2NaCl+2H2O ![]() H2↑+Cl2↑+2NaOH 生成4mol 的NaOH,(a为饱和食盐水),下列说法正确的是
H2↑+Cl2↑+2NaOH 生成4mol 的NaOH,(a为饱和食盐水),下列说法正确的是

A. 在X极生成2mol Cl2 B. 在X极生成2molH2
C. 在Y极生成4mol Cl2 D. NaOH在Y极生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应,又属于离子反应的是( )
A. 甲烷与氧气的反应 B. 铝片与稀盐酸的反应
C. 灼热的碳与二氧化碳反应生成一氧化碳 D. 氢氧化钠溶液与稀盐酸的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com