
【题目】解释下列事实的方程式不正确的是
A. 纯碱溶液遇酚酞变红:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. 以石墨为电极电解MgCl2溶液:2Cl-+2H2O ![]() Cl2↑+H2↑+20H-
Cl2↑+H2↑+20H-
C. 纯碱溶液处理锅炉中的水垢:CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)
CaCO3(s)+SO42-(aq)
D. 在Fe(NO3)2溶液中加稀硫酸有气体产生:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
【答案】B
【解析】A.碳酸钠的水解反应的离子反应为CO32-+H2OHCO3-+OH-;
B.用惰性电极电解MgCl2溶液,阴极产生H2和OH-,OH-与Mg2+生成沉淀;
C.水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去;
D. Fe(NO3)2溶液中含有二价铁离子和硝酸根离子,逐滴加入稀硫酸后,相当于加入了氢离子,溶液中存在了稀硝酸,稀硝酸能将亚铁离子氧化为三价,本身被还原为一氧化氮气体,所以溶液变为棕黄色,溶液中有NO气体放出。以此解答。
A.碳酸钠的水解反应的离子反应为CO32-+H2OHCO3-+OH-,故A正确;
B.用惰性电极电解MgCl2溶液,阴极产生H2和OH-,OH-与Mg2+生成沉淀,正确的离子方程式为:Mg2++2Cl-+2H2O ![]() Cl2↑+H2↑+Mg(0H)2↓,故B项错误;
Cl2↑+H2↑+Mg(0H)2↓,故B项错误;
C.水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去,离子方程式:CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq),故C正确;
CaCO3(s)+SO42-(aq),故C正确;
D. Fe(NO3)2溶液中含有二价铁离子和硝酸根离子,逐滴加入稀硫酸后,相当于加入了氢离子,溶液中存在了稀硝酸,稀硝酸能将亚铁离子氧化为三价,本身被还原为一氧化氮气体,溶液中有NO气体放出,离子方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,故D正确;
综上所述,本题正确答案为B。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】固体粉末X中可能含有Cu、FeO、Fe2O3、NaHCO3、Na2CO3、Na2S2O3、NaAlO2中的若干种。某化学兴趣小组为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下: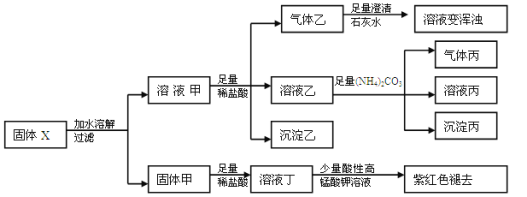
已知:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-下列说法正确的是( )
A. 气体乙和气体丙都为纯净物
B. 固体粉末X中一定含有FeO、Na2S2O3、NaAlO2 ,可能含有NaHCO3、Na2CO3
C. 溶液丁中的阳离子一定只含H+、Fe2+
D. 溶液甲中一定含有AlO2- ,可能含有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸镍((CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
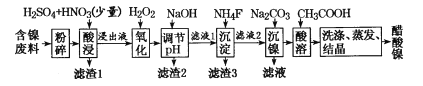
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:

(1)粉碎含镍废料的作用__________________________________
(2)酸浸过程中,l molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:___。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:____。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是____。
(5)滤渣3主要成分的化学式是____。
(6)沉镍过程中,若c(Ni2+)= 2.0 mol.L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为____g(保留一位小数)。
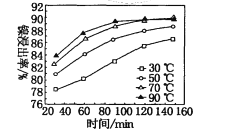
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为____℃、______min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应设计了图示实验装置。
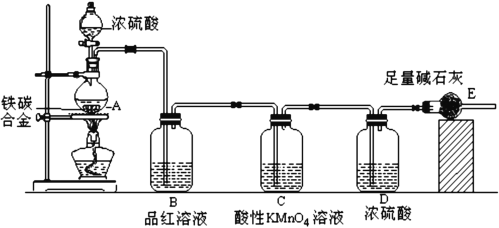
(1)在装药品开始实验前要进行的操作是_____
(2)a 克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A 无明显现象,其原因是常温下①_____;②_____。
(3)写出加热时 A 中碳与浓硫酸发生反应的化学方程式_____。
(4)B 中的现象是:_____;C 的作用是:_____。
(5)待 A 中不再逸出气体时,停止加热,拆下 E 并称重,E 增重 bg。则铁碳合金中铁的质量分数为_____(写含 a、b 的表达式)。
(6)经测定,(5)中测得结果偏小,原因可能是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化合物的元素组成的叙述,正确是
A. 蛋白质的元素组成中一定含有氮和硫
B. 脂肪的元素组成中一定含有碳和氮
C. 叶绿素的元素组成中一定含有碳和镁
D. 磷脂的元素组成中一定含有硫和磷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL、2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答:

(1)若在滴加NaOH溶液的过程中沉淀质量m随加入NaOH溶液的体积V变化如上图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=________ mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL、2 mol·L-1的H2SO4溶解此混合物后,再加入450 mL、1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 由C(石墨) = C(金刚石) △H=+1.9 kJ·mol-1可知,金刚石比石墨稳定
B. 在一定条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
C. 已知2C(s) + O2(g) = 2CO(g) △H=-221 kJ·mol-1,可知C的标准燃烧热为110.5 kJ·mol-1
D. 在一密闭容器中,9.6 g的硫粉与11.2 g的铁粉混合加热,充分反应,生成硫化亚铁17.6 g,放出19.12 kJ的热量,则Fe(s) + S(s) = FeS(s) △H= - 95.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合动力汽车(HEV) 中使用了镍氢电池,其工作原理如图所示:其中M 为储氢合金,MH 为吸附了氢原子的储氢合金,KOH 溶液作电解液。关于镍氢电池,下列说法不正确的是
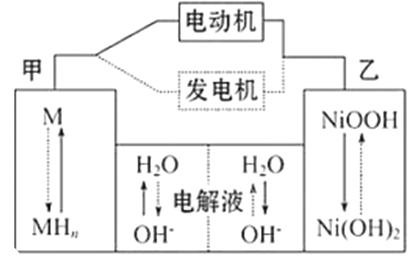
A. 充电时,阴极附近pH 降低
B. 电动机工作时溶液中OH-向甲移动
C. 放电时正极反应式为:NiOOH+H2O+e- =Ni(OH)2+OH-
D. 电极总反应式为:MH+NiOOH![]() M+Ni(OH)2
M+Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法不正确的是( )
A.除去乙烷中少量的乙烯:气体通入足量溴水
B.除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液
C.除去苯中少量苯酚:加入溴水,过滤
D.除去乙醇中少量的乙酸:加足量生石灰、蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com