
利用碳酸钠晶体(Na2CO3·10H2O)来配制0.5 mol/L的碳酸钠溶液1000 mL,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是
A. 称取碳酸钠晶体100 g
B. 定容时俯视观察刻度线
C. 移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗
D. 定容后,将容量瓶振荡均匀,静置发现液面低于刻度线,于是又加入少量水至刻度线
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:F2<Cl2 | B. | 气态氢化物的稳定性:H2O<H2S | ||
| C. | 酸性:H3PO4<H2SO4 | D. | 粒子半径:Na+>Na |
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.电解法精炼铜时,以粗铜作阴极,精铜作阳极
B.加热0.1mol/L的Na2CO3溶液,CO32-的水解程度和溶液的pH均增大
C.1L 1mol/L的NaClO溶液中含有ClO-的数目为6.02×1023
D.相同条件下,溶液中Fe2+、Cu2+、Zn2+的氧化性依次减弱
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
下列有关氮元索及其化合物的表示正确的是
A. 质子数为7、中子数为7的氮原子:147N
B. 氮原子的结构示意图:
C. 氨气分子的电子式:
D. 对硝基甲苯的结构简式: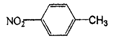
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
已知NH4CuSO3与足量的2 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是
A.反应中硫酸做氧化剂
B.NH4CuSO3中硫元素被氧化
C.1 mol NH4CuSO3完全反应转移0.5 mol电子
D.刺激性气味的气体是氨气
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制取少量溴乙烷的装置如下图所示,根据题意完成下列填空:
实验室制取少量溴乙烷的装置如下图所示,根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com