
| 化学键 | O═O | C≡O | C═O |
| 键能(kJ/mol) | 497 | 1072 | 803 |

分析 (1)①N2(g)+O2 (g)═2NO(g)△H=+180.0kJ/mol,△H=N≡N+497KJ-2N≡O=+180.0kJ/mol,2N≡O-N≡N=317KJ,先写出化学方程式2NO+2CO═N2+2CO2,然后根据焓变=反应物的总键能-生成物的总键能计算焓变,再根据化学方程式计算2molNO完全燃烧时放出的热量,标注物质聚集状态写出热化学方程式;
②A.到达平衡后各组分的含量不发生变化;
B.到达平衡后,反应前后气体物质的量变化,气体质量不变,结合$\overline{M}$=$\frac{总质量}{总物质的量}$分析;
C.到达平衡后正、逆速率相等,不再变化;
(2)①图象分析可知A点到B点二氧化硫转化率增大,说明A点未达到平衡状态,此时反应正向进行,但随反应物浓度减小,正反应速率减小;
②再次达到平衡时,能使O2的新平面浓度和原来平衡浓度相同,平衡不变,依据改变条件和影响平衡的因素分析判断选项;
(3)该燃料电池中,负极上通入NO2,正极上通入O2,根据电解质知,负极电极反应式为NO2-e-+NO3-═N2O5,正极电极反应式为O2+2N2O5+4e-═4NO3-,据此分析解答;
(4)根据题目信息写出方程式,建立关系式,然后依据关系式进行计算.
解答 解:(1)①N2(g)+O2 (g)═2NO(g)△H=+180.0kJ/mol,△H=N≡N+497KJ-2N≡O=+180.0kJ/mol,2N≡O-N≡N=317KJ,反应为2NO+2CO═N2+2CO2,△H=反应物的总键能-生成物的总键能=2×N≡O kJ•mol-1+2×1072 kJ•mol-1-N≡NkJ•mol-1-4×803 kJ•mol-1=-751.0kJ•mol-1,反应的热化学方程式为:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-751.0kJ•mol-1,
故答案为:751.0;
②A.NO的质量分数为定值,t1时刻处于平衡状态,故A正确,
B.该反应正反应为放热反应,随反应进行温度升高,平衡逆向进行,反应前后气体物质的量变化,气体质量不变,平均摩尔质量不变说明达到平衡状态,故B正确,
C、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故C错误;
故答案为:C.
(2)①一定温度的密闭容器中,分析SO2的转化率时间的变化可知A点到B点二氧化硫转化率增大,说明A点未达到平衡状态,此时反应正向进行,随反应进行浓度减小,反应速率减小,A点的正反应速率v正(SO2)<B点的正反应速率v正(SO2),
故答案为:小于;
②在某温度时,向10L的密闭容器中加入4.0mol SO2和10.0mol O2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平面浓度和原来平衡浓度相同,分析选项可知
A.在其他条件不变时,减少容器的容积,压强增大,平衡正向进行,体积减小氧气浓度增大,故A错误;
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2,为保持压强不变,体积增大,最后达到相同平衡状态,氧气浓度不变,故B正确;
C.保持温度和容器体积不变,温度不变平衡常数不变,K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$,再充入SO2和SO3,使之浓度扩大为原来的两倍,平衡常数不变,氧气浓度不变,故C正确;
故答案为:BC.
(3)该燃料电池中,负极上通入NO2,石墨Ⅰ为负极,电极反应式为NO2-e-+NO3-═N2O5,正极上通入O2,石墨Ⅱ为正极,电极反应式为O2+2N2O5+4e-═4NO3-,所以NO3-向负极移动,即NO3-向石墨Ⅰ;
依据O2+2N2O5+4e-═4NO3-,可知1mol氧气得到4mol电子,依据NO2-e-+NO3-═N2O5,1mol二氧化氮失去1mol电子,要使得失电子守恒:则消耗的O2和 NO2的体积比为1:4;
故答案为:正;NO2-e-+NO3-═N2O5;1:4;
(4)由题目信息可知,NO、NO2二者混合物与水反应生成亚硝酸,反应方程式为NO+NO2+H2O=2HNO2;亚硝酸再与尿素反应生成CO2和N2,反应方程式为CO (NH2)2+2HNO2=CO2+2N2+3H2O.
NO+NO2 ~2HNO2 ~CO(NH2)2
(30+46)g 1mol
1mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1:1)的质量为76g,
故答案为:76.
点评 本题考查了反应热、反应速率的计算、影响平衡移动的因素,电极反应式的书写,题目综合性强,明确化学平衡移动原理及影响因素、原电池工作原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
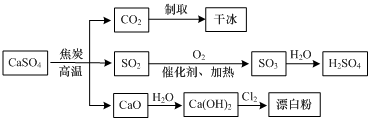
| A. | CO2制取干冰的过程吸收热量,属于物理变化 | |
| B. | 硫酸钙与焦炭反应时生成的n(CO2):n(SO2)=1:2 | |
| C. | 由SO2制取H2SO4的过程均为氧化还原反应 | |
| D. | 石灰乳与Cl2反应制取漂白粉时,Cl2仅作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯在空气中燃烧时有黑烟,因此可以用燃烧法区别甲烷和乙烯 | |
| B. | 苯与浓硝酸在浓硫酸存在条件下加热发生取代反应 | |
| C. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性 | |
| D. | 氨基酸能够以不同数目和顺序相结合形成结构复杂的多肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
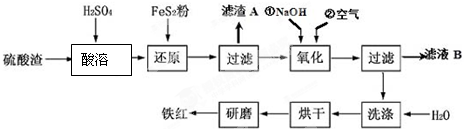
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀Ph | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
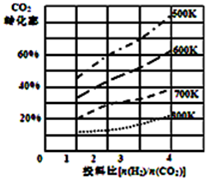 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)| P1 | P2 | P3 | |
| I.2.0molCO2 6.0molH2 | 0.10mol | 0.04mol | 0.02mol |
| Ⅱ.1.0mol CO2 3.0molH2 | X1 | Y1 | Z1 |
| Ⅲ.1.0molCH3OCH3 3.0molH2O | X2 | Y3 | Z2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
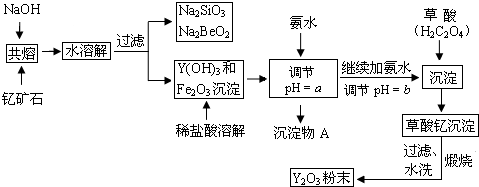
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4溶液与NaOH溶液混合 | B. | HCl气体通入Ca(OH)2溶液中 | ||
| C. | HNO3溶液与KOH溶液混合 | D. | NH4HSO4溶液与NaOH溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
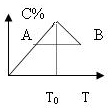 对于反应2A+B?2C的反应过程中C的百分含量随温度的变化如图所示,则:
对于反应2A+B?2C的反应过程中C的百分含量随温度的变化如图所示,则:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有部分元素的存在,性质和原子结构如下所述:
现有部分元素的存在,性质和原子结构如下所述:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com