
 2SO3(g)达到平衡状态的标志是______。
2SO3(g)达到平衡状态的标志是______。| A.υ(O2)正=2υ(SO2)逆 |
| B.容器中气体的总质量不随时间而变化 |
| C.容器中气体的颜色不随时间而变化 |
| D.容器中气体的压强不随时间而变化 |
 2SO3(g) ΔH<0。下列图像中不正确的是______ (填字母序号)。
2SO3(g) ΔH<0。下列图像中不正确的是______ (填字母序号)。
 O2(g)
O2(g)  SO3(g) ΔH=-98KJ/mol
SO3(g) ΔH=-98KJ/mol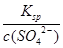 =
=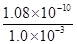 =1.08×10-7mol/L,混合前的弄得为2.16×10-7mol/L。
=1.08×10-7mol/L,混合前的弄得为2.16×10-7mol/L。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源:不详 题型:填空题
 pC达到平衡,若:
pC达到平衡,若:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是| A.达到化学平衡时,化学反应速率的关系是2v逆(NH3)=3v正 (H2O) |
| B.达到化学平衡时,NH3、O2、NO、H2O物质的量之比为4∶5∶4∶6 |
| C.混合气体的密度一定时,该化学反应达到化学平衡 |
| D.若单位时间内生成x mol NO的同时,生成x mol NH3,则反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 H2(g)+CO2(g),当反应达平衡时,CO的体积分数为X,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数不等于X的有
H2(g)+CO2(g),当反应达平衡时,CO的体积分数为X,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数不等于X的有 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 xC(g)的生成物C在反应混合物中的百分含量w(C)和反应时间(t)的关系。下列说法与图像符合的是
xC(g)的生成物C在反应混合物中的百分含量w(C)和反应时间(t)的关系。下列说法与图像符合的是
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Cu2+ (aq) + 2Ag (s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是
Cu2+ (aq) + 2Ag (s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是
| A.KNO3盐桥中的K+移向Cu(NO3)2溶液 |
| B.当电流计指针为0时,该反应达平衡,平衡常数K=0 |
| C.若此时向AgNO3溶液中加入NaCl固体,随着NaCl量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转 |
| D.若此时向Cu(NO3)2溶液中加入NaOH固体,随着NaOH量的增加电流计指针向右偏转幅度减小→指针指向0→向左偏转 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2CH3COOH(g)经试验测得在不同压强下体系的平均相对分子质量(M)随温度T的变化曲线如图所示,下列说法正确的是
2CH3COOH(g)经试验测得在不同压强下体系的平均相对分子质量(M)随温度T的变化曲线如图所示,下列说法正确的是
| A.该过程的△H<0 |
| B.平衡常数: K(a)=K(b)<K(c) |
| C.气体压强:P(a)<P(b)= P(c) |
| D.当M=80时,(CH3COOH) 2和CH3COOH的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
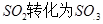 是一个关键的步骤。
是一个关键的步骤。 。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。 mol
mol ,发生反应:
,发生反应: ,达平衡后改变下述条件,
,达平衡后改变下述条件, 气体平衡浓度都比原来增大的是____________(填字母)。
气体平衡浓度都比原来增大的是____________(填字母)。A.保持温度和容器体积不变,充入2mol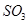 |
| B.保持温度和容器体积不变,充入2molN2 |
C.保持温度和容器内压强不变,充入1mol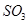 |
| D.移动活塞压缩气体 |
 反应的图像中,不正确的是_________。
反应的图像中,不正确的是_________。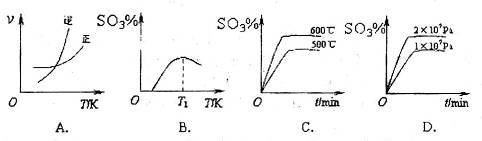
 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
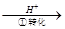 Cr2O72-
Cr2O72-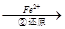 Cr3+
Cr3+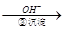 Cr(OH)3↓
Cr(OH)3↓  Cr2O72- (橙色)+H2O
Cr2O72- (橙色)+H2O Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com