
【题目】某实验小组设计了如下图装置,不断改变A中溶液成份反应以探究SO2气体的性质
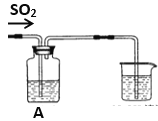
(1)如果A中盛有氢硫酸溶液,通入SO2气体后可观察到有浅黄色浑浊出现,则证明SO2有_________性;写出化学反应方程式____________________________________
(2)如果A中盛有酸性高锰酸钾溶液,通入SO2气体后实验现象是________________,证明SO2有_______性。
(3)如果A中盛有稀硝酸钡溶液, 通入SO2气体后可观察到出现白色沉淀,有无色NO气体生成,写出离子反应方程式_______________________________________________。
(4)如果A中盛有氯化钡溶液,通入SO2气体后本应无沉淀生成,但同学们发现在溶液中也有少量白色沉淀。甲同学把此白色沉淀过滤出来,该沉淀不溶于盐酸。该同学猜测是由于装置中空气没有排净,参与了反应,试写出离子反应方程式_____________________________________。
(5)如果A中盛有纯碱水溶液,写出向A中缓缓加入少量SO2的离子反应方程式____________________________________
【答案】 氧化性 2H2S +SO2=3S↓+2H2O 紫红色溶液褪色 还原性 3Ba2++3SO2+2NO3-+2H2O=2NO+3BaSO4↓+4H+ 2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+ SO2+H2O+2CO32-=SO32-+2HCO3-
【解析】考查实验方案设计的评价以及二氧化硫的化学性质,(1)有淡黄色沉淀产生,即生成S单质,发生的反应是2H2S+SO2=3S↓+2H2O,SO2中S的价态降低,因此SO2作氧化剂,即体现SO2的氧化性;(2)酸性高锰酸钾具有强氧化性,SO2中S显+4价,处于中间价态,既具有氧化性又具有还原性,因此SO2通入酸性高锰酸钾溶液中,紫红色褪去,体现SO2的还原性;(3)NO3-在酸性条件下具有强氧化性,能把SO2氧化成SO42-,本身被还原成NO,然后SO42-与Ba2+结合生成BaSO4沉淀,即离子方程式为3Ba2++3SO2+2NO3-+2H2O=2NO+3BaSO4↓+4H+;(4)白色沉淀不溶于盐酸,白色沉淀是BaSO4,因此反应式为Ba2++SO2+O2→BaSO4↓,SO2中S的价态由+4价→+6价,化合价升高2价,O2中O的化合价降低2价,共降低4价,最小公倍数为4,然后配平其他,即离子反应方程式为2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+ ;(5) 亚硫酸的酸性强于碳酸,因为通入SO2是少量,因此离子反应方程式为SO2+H2O+2CO32-=SO32-+2HCO3-。


科目:高中化学 来源: 题型:
【题目】某同学欲用已知物质的量浓度为0.100 0 mol·L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化,如何判断滴定终点: 。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 (填序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(3)若第一次滴定开始和结束时,酸式滴定管中的液面如下图所示。则起始读数为V1= mL,终点读数V2= mL。
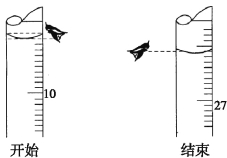
(4)再结合下表数据,计算被测氢氧化钠溶液的物质的量浓度是 mol·L-1。
滴定次数 | 待测溶液体积/mL | 标准酸体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
第一次 | 10.00 | V1 | V2 |
第二次 | 10.00 | 4.10 | 21.10 |
第三次 | 10.00 | 0.40 | 17.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
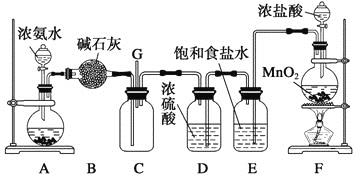
(1)装置A中的烧瓶内固体不可以选用___________________(选填序号)。
A.生石灰 B.碱石灰 C.五氧化二磷 D.烧碱
(2)装置F中发生反应的化学方程式是_____________________________________________。
(3)B装置的作用__________________;E装置的作用__________________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:__________________________________________。当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数常数为_____________mol-1 (用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 镁合金被大量用于制造火箭、导弹和飞机的部件
B. 硫酸铜可作泳池池水消毒剂
C. 碳酸钠可用于中和胃酸过多
D. 氢氧化铁胶体能用于净水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖原[(C6H10O5)n]是一种相对分子质量比淀粉更大的多糖,主要存在于肝脏中,所以又叫动物淀粉和肝糖。下列关于糖原的叙述正确的是( )
A. 糖原与淀粉、纤维素互为同分异构体 B. 糖原、淀粉、纤维素属于同系物
C. 糖原水解的最终产物是葡萄糖 D. 糖原具有还原性,能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒, 因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
A.酸性 B.碱性 C.氧化性 D.还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A. 1 mol Na2O2中含有的阴离子数为2NA
B. 标准状况下,由H2O2制得2.24LO2转移的电子数目为0.4NA
C. 常温常压下,8g O3含有4 NA个电子
D. 常温下,1L pH=2的H2SO4溶液中含有的H+数目为0.02NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com