
【题目】人体内有多种微量元素,它们的含量很低,但是对人体的健康却起着重要作用。下列各元素全部是微量元素的是( )
A. Na、K、Cl、S、O
B. Fe、Zn、Cu、Mn
C. H、O、C、N、P
D. Cu、Ca、Mg、C
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】(1)合成氨是人类科技发展史上的一项重大突破。已知:25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ/mol。请回答下列问题:
2NH3(g) ΔH=-92.4kJ/mol。请回答下列问题:
①其他条件不变时,升高温度,化学反应速率______(填“增大”或“减小”);
②25℃时,取1mol N2和3mol H2置于2L的密闭容器中,在催化剂存在下进行反应,达到平衡时放出的热量________
A.大于92.4 kJ
B.等于92.4 kJ
C.小于92.4 kJ
③一定条件下,上述反应达到化学平衡状态的标志是_______;
A.N2、H2、NH3的浓度相等
B.容器内压强不再变化
C.单位时间内消耗amol N2,同时生成2amol NH3
④25℃时,上述反应平衡常数的表达式为:K=_________________。
(2)如图是电解NaCl溶液的示意图。请回答下列问题:
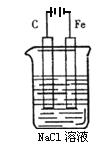
①石墨电极上的反应式为______________;
②电解一段时间后,溶液的pH_________(填“增大”、“减小”或“不变”)。
(3)水溶液中的离子平衡是化学反应原理的重要内容。请回答下列问题:
①常温下,0.1mol/LCH3COONa溶液呈______(填“酸”、“碱”或“中”)性,溶液中c(Na+)_______c(CH3COO-)(填“>”、“<”或“=”);
②常温下,在浓度均为0.1mol/L的盐酸和NH4Cl溶液中,水的电离程度大小关系是:0.1mol/L盐酸______0.1mol/LNH4Cl溶液(填“>”、“<”或“=”);
③已知:20℃时,Ksp(AgCl)=1.1×10-10,Ksp(AgBr)=2.0×10-13。将AgCl和AgBr的饱和溶液等体积混合,再逐滴加入足量浓AgNO3溶液,充分反应后,生成沉淀量的关系是:m(AgCl)_______m(AgBr)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们的衣食住行中都蕴含着丰富的化学知识,下列说法中正确的是
A.衣料中的蚕丝和涤纶都属于合成有机高分子材料
B.加碘食盐和铁强化酱油都可以补充人体必需的微量元素
C.建筑高楼大厦时用到的钢是纯净物
D.用液化石油气代替汽油作汽车燃料,不会造成空气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是过氧化氢(H2O2)分子和O3分子的空间结构示意图。请回答:


(1) O3分子中非极性共价键是__________键,特殊的化学键是________键。
(2)臭氧与氧气的关系是________。
(3)下列物质的分子与O3分子的结构最相似的是________。
A.H2O B.CO2 C.SO2 D.BeCl2
(4)分子中某一原子有一对没有跟其他原子共用的电子对叫孤电子对。那么,O3分子中有________对孤电子对。
(5)下列关于过氧化氢的说法中正确的是________(用序号填空)。
①分子中有极性键 ②分子中有非极性键 ③氧原子的轨道发生了sp2杂化 ④O—O共价键是pp σ键 ⑤分子是非极性分子
(6)过氧化氢易溶于水,主要原因是_______________________________。
(7)指出下列原子的杂化轨道类型及分子的空间构型。
①SiF4中的Si____杂化,空间构型____;②NO![]() 中的N___杂化,空间构型___。
中的N___杂化,空间构型___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如图所示。
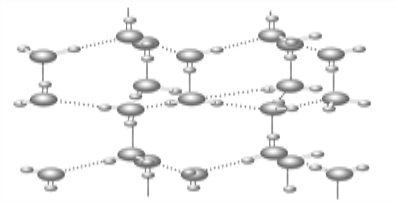
(1)1 mol H2O形成的冰中有________mol“氢键”。
(2)水分子可电离生成两种含有相同电子数的微粒,其电离方程式为________。
(3)在冰晶体中除氢键外,还存在范德华力(11 kJ·mol-1)。已知冰的升华热是51 kJ·mol-1,则冰晶体中氢键的能量是________ kJ·mol-1。
(4)氨气极易溶于水的原因之一也是与氢键有关。请判断NH3溶于水后,形成的NH3·H2O的合理结构是________(填序号)。

(5)NH3与PH3相比,热稳定性更强的是__________
(6)NH3、PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是____
A.键的极性N—H比P—H强
B.分子的极性NH3比PH3强
C.相对分子质量PH3比NH3大
D.NH3分子之间存在特殊的分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于DNA和RNA的叙述中,正确的是( )
A. 只有细胞核含有DNA
B. DNA和RNA都是由两条核苷酸链组成
C. 组成核酸的碱基共有5种
D. RNA只分布在细胞质中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作及预期结果均正确的是( )
选项 | 实验操作 | 预期结果 |
A | 将湿润的NH3通过盛有无水CaCl2的干燥管 | 可得到干燥的NH3 |
B | 将乙烯、乙醇蒸气分别通入酸性KMnO4溶液中 | 两者均能使KMnO4溶液褪色 |
C | Na2O2与湿润的红色试纸接触 | 试纸只变蓝不褪色 |
D | 将CO2通入CaCl2溶液中 | 可得到白色沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com