
【题目】某人设计淀粉利用方案如图所示:其中:A是衡量国家石油化工的重要标志,能催熟水果,B是高分子化合物,D是有水果香味的物质。
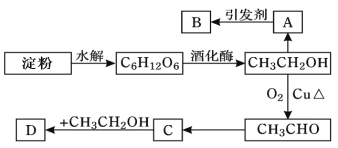
(1)“C6H12O6”的名称是__,A的电子式为__,C中含有官能团名称__。
(2)A→B反应类型__。
(3)写出下列转化的化学方程式
C→D:__,
CH3CH2OH→CH3CHO:__。
【答案】葡萄糖 ![]() 羧基 加聚反应 CH3COOH+CH3CH2OH
羧基 加聚反应 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 2CH3CH2OH+O2
CH3COOCH2CH3+H2O 2CH3CH2OH+O2![]() 2CH3CHO + 2H2O
2CH3CHO + 2H2O
【解析】
淀粉水解生成葡萄糖;乙醇发生消去反应得到A(CH2=CH2),乙烯发生加聚反应得到高分子化合物B,B为![]() ;D是有水果香味的物质,属于酯,C与乙醇发生酯化反应得到D,由转化关系可知C为羧酸,则C为CH3COOH,D为乙酸乙酯,据此解答。
;D是有水果香味的物质,属于酯,C与乙醇发生酯化反应得到D,由转化关系可知C为羧酸,则C为CH3COOH,D为乙酸乙酯,据此解答。
(1)淀粉水解生成葡萄糖;CH2=CH2的电子式为![]() ;C为CH3COOH,含有羧基;
;C为CH3COOH,含有羧基;
(2)A→B是乙烯发生加聚反应得到高分子化合物![]() ;
;
(3)C→D是乙酸与乙醇发生酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;CH3CH2OH→CH3CHO方程式为2CH3CH2OH+O2
CH3COOCH2CH3+H2O;CH3CH2OH→CH3CHO方程式为2CH3CH2OH+O2![]() 2CH3CHO + 2H2O。
2CH3CHO + 2H2O。


科目:高中化学 来源: 题型:
【题目】常温下,三硫代碳酸钠(Na2CS3)是玫瑰红色针状固体,与碳酸钠性质相近。在工农业生产中有广泛的用途。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验一:探究Na2CS3的性质
(1)向Na2CS3溶液中滴入酚酞试液,溶液变红色。用离子方程式说明溶液呈碱性的原因_________。
(2)向Na2CS3溶液中滴加酸性KMnO4溶液,紫色褪去。该反应中被氧化的元素是__________。
实验二:测定Na2CS3溶液的浓度
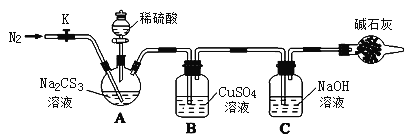
按如图所示连接好装置,取50.0mLNa2CS3溶液置于三颈瓶中,打开分液漏斗的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。
已知:Na2CS3+ H2SO4=Na2SO4+ CS2+ H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,密度1.26g/mL,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(1)盛放碱石灰的仪器的名称是_______,碱石灰的主要成分是______(填化学式)。
(2)C中发生反应的离子方程式是____________。
(3)反应结束后打开活塞K,再缓慢通入N2一段时间,其目的是_________。
(4)为了计算Na2CS3溶液的浓度,对充分反应后B中混合物进行过滤、洗涤、干燥、称重,得8.4g 固体,则三颈瓶中Na2CS3的物质的量浓度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置模拟“侯氏制碱法”,通过制备的NH3和CO2,与饱和食盐水反应先制备NaHCO3。下列说法正确的是( )
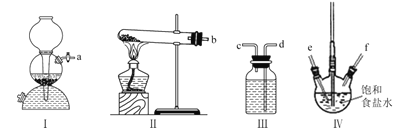
A.实验时装置I产生的气体应先通人到装置IV中
B.装置II中的试剂为浓硫酸
C.导管口的连接顺序为a-e-f-d-c-b
D.实验过程中,装置IV内会出现浑浊现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、理象和结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 向某溶液中加入NaOH 溶液,并用湿润的红色石蕊试纸检验 | 试纸没有变蓝 | 原溶液中没有有NH4+ |
B | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
C | 向某溶液中滴加氯水后,再加KSCN溶液 | 溶液变红 | 原溶液中一定有Fe2+ |
D | 向某无色溶液中滴加BaCl2溶液 | 产生白色沉淀 | 该无色溶液中一定含有SO42- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W原子的最外层电子数是其质子数的![]() ,X原子的核电荷数等于Z原子的最外层电子数,元素Y的最高正化合价为+2价。下列说法正确的是( )
,X原子的核电荷数等于Z原子的最外层电子数,元素Y的最高正化合价为+2价。下列说法正确的是( )
A.单质的沸点:W<X
B.简单离子的半径:Z>Y
C.X、Z的氧化物对应的水化物均为强酸
D.X、Y可形成离子化合物X3Y2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,总反应为2Na+xS![]() Na2Sx,其反应原理如图所示。下列叙述正确的是( )
Na2Sx,其反应原理如图所示。下列叙述正确的是( )
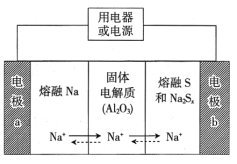
A.放电时,电极a为正极
B.放电时,内电路中Na+的移动方向为从b到a
C.充电时,电极b的反应式为Sx2--2e-=xS
D.充电时,Na+在电极b上获得电子,发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
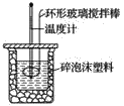
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的酸用水冲洗干净;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
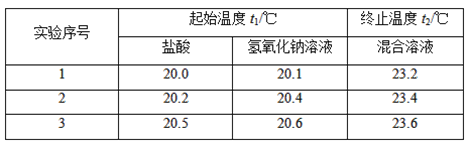
依据该学生的实验数据计算,该实验测得的中和热ΔH=________(结果保留一位小数)。
(3)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol·L-1,则H2反应速率为0.03mol·L-1·min-1
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com