
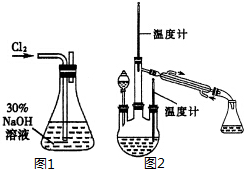
 ������Ҫ�Ļ���ԭ�ϣ�ij̽��С���������з�Ӧ��ȡˮ���£�N2H4•H2O����
������Ҫ�Ļ���ԭ�ϣ�ij̽��С���������з�Ӧ��ȡˮ���£�N2H4•H2O�������� ��1������һ��������������Һʱ�����岽���Ǽ��㡢�������ܽ⣬NaOH����ʱ��Ҫ�����ձ��гƣ���ȡˮʱ��Ҫ��Ͳ���ܽ�ʱ��Ҫ�ձ�����������
��2������ͨ�뵽ʢ��NaOH����ƿ����NaOH������Ӧ�����Ȼ��ơ��������ƺ�ˮ��
��3���к͵ζ��ⶨ�����Һ��NaOH��Ũ��ʱ����Ҫ�ų���Һ���NaClO�ĸ��ţ���ͨ�����뻹ԭ�ԵĹ������⣬������������������û������Һ�����������ʣ�����ѡ��FeCl2��Һ��ԭ��������������Fe3+������NaOH����Fe��OH��3��������ѡ��ָʾ�������к͵ζ��Ϳ����ˣ�
��4��������ȡˮ���£�N2H4•H2O���ķ�Ӧԭ��Ϊ��CO��NH2��+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl����Ϸ�Ӧ����ͷ�Ӧ������жϣ�ˮ���£�N2H4•H2O�����л�ԭ�ԣ��ױ���������������
��5��NaHCO3��ͨ����⻯��ķ�Ӧ������Һ��pH��6.5���ң�
��6����Ϸ�Ӧ������ϵ����õ������ˮ���£�N2H4•H2O��������������
��� �⣺��1������һ��������������Һʱ���ܽ�ʱ��Ҫ�ձ�����������
�ʴ�Ϊ��BD��
��2����ƿ��������NaOH��Ӧ�����Ȼ��ơ��������ƺ�ˮ��
�ʴ�Ϊ��Cl2+2NaOH=NaClO+NaCl+H2O��
��3���к͵ζ��ⶨ�����Һ��NaOH��Ũ��ʱ����Ҫ�ų���Һ���NaClO�ĸ��ţ���ͨ�����뻹ԭ�Ե�H2O2��ȥNaClO��Ȼ��μӼ���ָʾ�������ñ�������ζ����NaOH��Һ��Ũ�ȣ�
�ʴ�Ϊ��ȡһ������ƿ�ڻ����Һ������������H2O2��Һ�μ�2��3�μ�����Һ���� 0.100mol•L-1����ζ����ظ���������2��3�Σ�
��4����ӦCO��NH2��+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl�У�ˮ���£�N2H4•H2O������ԭ�������л�ԭ�ԣ��ױ���������������
�ʴ�Ϊ��B���������������Һװ����ƿ�У���Ӧ���ɵ�ˮ���»ᱻ��������������
��5��NaHCO3�ܿ�����Һ��pH��6.5���ң�����Ϊ̼�����ƺ͵⻯�ⷴӦ���ʴ�Ϊ��NaHCO3����ζ������в�����HI��Ӧ��
��6����Ϸ�Ӧ������ϵ����õ������ˮ���£�N2H4•H2O��������������
N2H2•H2O+2I2=N2+4HI+H2O
1 2
n 0.1000mol/L��0.016L
n=0.0008mol
250ml��Һ�к��е����ʵ���=0.0008mol��$\frac{250}{25}$=0.008mol
ˮ���£�N2H2•H2O������������=$\frac{0.008mol��50g/mol}{5.00g}$��100%=8.0%
�ʴ�Ϊ��8.0%��
���� ���⿼���������Ʊ������ʵ�ʵ���������֤����Ӧ�ã���Ҫ�ǹ��̷����жϣ����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
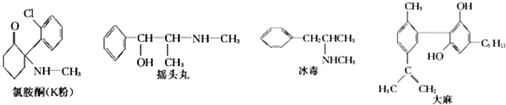
| A�� | �����������ᷴӦ | |
| B�� | ҡͷ��������� | |
| C�� | 1molK����������4molH2�����ӳɷ�Ӧ | |
| D�� | �ʵ������£�1mol����������3mol Br2������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��Al2��SO4��3��MgSO4�Ļ����Һ�У��μ�NaOH��Һ�����ɳ������������NaOH��Һ�������ϵ��ͼ��ʾ����ԭ���Һ��Al2��SO4��3��MgSO4�����ʵ���Ũ��֮��Ϊ��������
��Al2��SO4��3��MgSO4�Ļ����Һ�У��μ�NaOH��Һ�����ɳ������������NaOH��Һ�������ϵ��ͼ��ʾ����ԭ���Һ��Al2��SO4��3��MgSO4�����ʵ���Ũ��֮��Ϊ��������| A�� | 6��1 | B�� | 1��2 | C�� | 2��1 | D�� | 3��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ba��OH��2?Ba2++2 OH- | B�� | H3PO4?3 H++PO43- | ||
| C�� | NaHCO3�TNa++H++CO3 2- | D�� | HClO?H++ClO- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڷ�Ӧ�ٺ͢��У��Ȼ��ƾ����������������ǻ�ԭ�� | |
| B�� | �ڷ�Ӧ���������ǻ�ԭ����ڷ�Ӧ���������ǻ�ԭ���� | |
| C�� | ����״�������ɵ���������壬��Ӧ�ٺ͢���ת�Ƶ���������� | |
| D�� | �����ĵ��������Ȼ��ƣ���Ӧ�ٺ͢���ת�Ƶ���������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com