
| 元素 | X | Y | Z | W |
| 原子半径 | 0.102 | 0.16 | 0.074 | 0.071 |
| 最高正价或最低负价 | +6 | +2 | -2 | -1 |
| A. | HW是热稳定性最强的氢化物 | |
| B. | Z的最高正价为+6 | |
| C. | 原子序数X>Y>Z>W | |
| D. | 纯净的X单质与纯净的Z单质反应生成XZ3 |
分析 X、Y、Z、W四种短周期主族元素,Y的原子半径最大,且Y为+2价,可知Y为Mg,X的最高价为+6价,最低价应为-2价,则X为S,结合原子半径可知Z只能为O,则W为F,然后结合元素周期律及元素化合物知识来解答.
解答 解:由上述分析可知,X为S,Y为Mg,Z为O,W为F,
A.F的非金属性最强,则HW是热稳定性最强的氢化物,故A正确;
B.Z为O,无正价,故B错误;
C.由元素在周期表的位置可知,原子序数X>Y>W>Z,故C错误;
D.纯净的X单质与纯净的Z单质反应生成SO2,故D错误;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用及O、F无正价,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的有机物有三种,它们互为同系物 | |
| B. | 淀粉和纤维素的化学式相同,化学性质相似 | |
| C. | 乙酸乙酯在过量氢氧化钠溶液中加热,生成乙酸和乙醇 | |
| D. | 溶解度:甘油>1-丁醇>甲酸甲酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的总分子数不再发生变化 | B. | 混合气体的颜色不再发生变化 | ||
| C. | 反应放出的热量为9.4KJ | D. | n(H2):n(I2):n(HI)=1:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,电子由石墨沿导线流向铝 | |
| B. | 放电时,正极反应式为:Al+Li++e-═AlLi | |
| C. | 充电时,铝电极质量增加 | |
| D. | 充电时,PF6-向阴极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯分子中含有碳碳双键 | |
| B. | 油脂的皂化反应属于加成反应 | |
| C. | 糖类物质均可直接食用并能被人体吸收 | |
| D. | 以淀粉为原料可制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
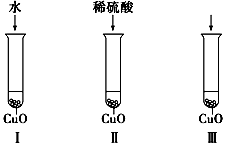 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过如图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过如图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中c(K+)为1 mol•L-1 | |
| B. | 上述电解过程中共转移4 mol电子 | |
| C. | 电解得到的Cu的物质的量为0.5 mol | |
| D. | 电解后溶液中c(H+)为2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属性:丙>甲 | |
| B. | 原子半径:r(丁)>r(丙)>r(乙)>r(甲) | |
| C. | 乙、丙、丁的简单离子的电子层结构相同 | |
| D. | 甲和乙以1:4形成的简单阳离子含11个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com