
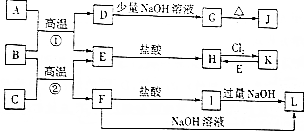
 ;
;分析 B为红棕色粉末,应为Fe2O3,A为无色有毒气体,结合转化关系,可推知A具有还原性,故A为CO,则D为CO2,E为Fe;顺推可知G为NaHCO3,J为Na2CO3,H是FeCl2,K为FeCl3,金属C与氧化铁反应生成Fe与F,F为金属氧化物,既与盐酸反应又能与氢氧化钠反应,F应为Al2O3,则C是Al,I为AlCl3,L为NaAlO2,结合物质的性质解答该题.
解答 解:(1)D为CO2,电子式为 ,故答案为:
,故答案为: ;
;
(2)K为FeCl3,故答案为:FeCl3;
(3)B与C高温反应生成E和F的化学方程式为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$A12O3+2Fe,故答案为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$A12O3+2Fe;
(4)二氧化碳与碳酸钠稀溶液反应生成生成碳酸氢钠,反应离子方程式为:CO2+CO32-+H2O=2HCO3-,故答案为:CO2+CO32-+H2O=2HCO3-.
点评 本题考查无机物的推断,为高考常见题型,题目难度中等,B的颜色是推断突破口,再结合转化关系与A的性质进行推断,侧重考查元素化合物性质,学习中注意把握.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
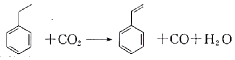
| A. | 分子中含有4个碳碳双键 | B. | 属于不含极性键的共价化合物 | ||
| C. | 分子式为C8H10 | D. | 通过加聚反应生成聚苯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
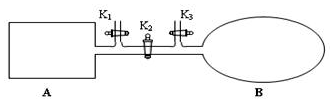 我国于2016年10月17日在酒泉卫星发射中心由“长征二号”FY11运载火箭发射“神舟十一号”载人飞船.“长征二号”FY11运载火箭使用的氧化剂是N2O4.如图,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,通过K1、K3分别向容器A、气囊B中充入1molNO2,发生反应:2NO2(g)?N2O4(g).反应起始时A、B的体积均为1L.
我国于2016年10月17日在酒泉卫星发射中心由“长征二号”FY11运载火箭发射“神舟十一号”载人飞船.“长征二号”FY11运载火箭使用的氧化剂是N2O4.如图,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,通过K1、K3分别向容器A、气囊B中充入1molNO2,发生反应:2NO2(g)?N2O4(g).反应起始时A、B的体积均为1L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能发生取代反应的只有①、④和⑤ | |
| B. | 能与H2发生加成反应的只有②和③ | |
| C. | 所有原子位于同一平面的只有②和③ | |
| D. | 能发生水解反应生成两种有机物的只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a1>a2,c1>c2 | B. | a1<a2,c1<c2 | C. | a1>a2,c1<c2 | D. | a1<a2,c1>c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的铁在氯气中燃烧生成FeCl3,过量的铁在氯气中燃烧生成FeCl2 | |
| B. | 用pH试纸可测得氯水的pH值 | |
| C. | 溴化钠溶液中加入少量新制氯水振荡,再加入少量四氯化碳振荡,静置后,上层颜色变浅,下层颜色变橙红色 | |
| D. | 由Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO,可推出Ca(ClO)2+SO2+H2O═CaCO3↓+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com