
����Ŀ����֪A��B��C��D��E��F��ԭ���������������ǰ������Ԫ�أ�A��Cͬ���壬A��B��A��E�γɹ��ۻ����A��B�γɵ���������ˮ��Һ�ʼ��ԣ�E����������ϼ���������ϼ۵Ĵ�����Ϊ4��D��ͬ�����м����Ӱ뾶��С��Ԫ�أ�FԪ�ض�Ӧ�ĵ���Ϊ�ճ������г���������
��1��F��Ԫ�����ڱ��е�λ��ʱ_____��
��2��B��D��E�ļ����Ӱ뾶�ɴ�С��˳��Ϊ_____�����ӷ��ű�ʾ����
��3��B����̬�⻯����������������Ӧ��ˮ���ﷴӦ���ɵĻ������д��ڵĻ�ѧ������Ϊ_____��д������û������������ӵ����ӷ���ʽ_____��
��4��д����A��BԪ���γɵ����˷��ӵĵ���ʽ_____��
��5����֪�����»�����FE��Ksp=6��10��18mol2L��2�������½�1.0��10��5molL��1��Na2E��Һ�뺬FSO4��Һ�������3��2��ϣ����г���FE���ɣ��������FSO4��Ũ��������_____�������Ի�Ϻ���Һ������仯����
ͼ�о���D��FԪ�ص����ʾ�����ͼʾת����ϵ��
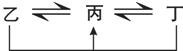
������DԪ�ص��ҡ������������ת��ȫΪ��������ԭ��Ӧ��
������FԪ�ص��ң����ʣ��������������ת��ȫΪ������ԭ��Ӧ��
��ش��������⣺
a��������DԪ�ص����붡����Һ�з�����Ӧ�����ӷ���ʽ_____��
b���������ֱ��Ǻ�FԪ�صļ������ӣ����麬�������������ӵĻ����Һ�еĵͼ����ӣ�����������KMnO4��Һ�����Ӧ�����ӷ���ʽΪ��_____��
���𰸡� �������ڵ�VIII�� S2����N3����Al3+ ���Ӽ����ۼ� NH4++OH��![]() NH3��+H2O
NH3��+H2O ![]() 2.5��10��12 mol/L Al3++3AlO2��+6H2O=4Al��OH��3�� 5Fe2++MnO4��+8H+=5Fe3++Mn2++4H2O
2.5��10��12 mol/L Al3++3AlO2��+6H2O=4Al��OH��3�� 5Fe2++MnO4��+8H+=5Fe3++Mn2++4H2O
�����������������A��B��C��D��E��F��ԭ���������������ǰ������Ԫ�أ�A��Cͬ���壬A��B��A��E�γɹ��ۻ�������A��B�γɵ���������ˮ��Һ�ʼ��ԣ���A��B�γɵ����������NH3 ����AΪH��BΪN��CΪNa��E����������ϼ���������ϼ۵Ĵ�����Ϊ4�������Ϊ+6����ͼ�Ϊ-2��EΪS��D��ͬ�����м����Ӱ뾶��С��Ԫ����DΪAl��FԪ�ض�Ӧ�ĵ���Ϊ�ճ������г���������FΪFe��
��1��FeΪ26��Ԫ�أ���Ԫ�����ڱ��е�λ��ʱ�������ڵ�VIII�壮
��2��B��D��E�ļ���������S2����3�����Ӳ����뾶�ϴ���N3����Al3+ֻ��2�����Ӳ��Һ�������Ų���ͬ���˵������İ뾶��С�����뾶�ɴ�С��˳��ΪS2����N3����Al3+��
��3��B����̬�⻯����NH3����������������Ӧ��ˮ������HNO3����Ӧ���ɵĻ�������NH4NO3�����д��ڵĻ�ѧ������Ϊ���Ӽ����ۼ�������NH4+�����ӷ���ʽNH4++OH��![]() NH3��+H2O��
NH3��+H2O��
��4����A��BԪ���γɵ����˷���ΪN2H4����ĵ���ʽ![]() ��
��
��5�������»�����FeS��Ksp=6��10��18mol2L��2�������½�1.0��10��5molL��1��Na2S��Һ�뺬FeSO4��Һ�������3��2��ϣ�c(S2-)=![]() 1.0��10��5molL��1�����г���FeS���ɣ�����Һ��c(Fe2+)����Ϊ
1.0��10��5molL��1�����г���FeS���ɣ�����Һ��c(Fe2+)����Ϊ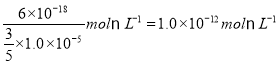 ���������FeSO4��Ũ��������
���������FeSO4��Ũ��������![]() 2.5��10��12 mol/L��
2.5��10��12 mol/L��
�پ���DԪ�ص��ҡ������������ת��ȫΪ��������ԭ��Ӧ�����һ���������������ҺͶ��ֱ������κ�ƫ�������е�һ����
�ھ���FeԪ�ص��ң����ʣ��������������ת��ȫΪ������ԭ��Ӧ������Ϊ������Ϊ+3�����Ļ������Ϊ+2�����Ļ�������
a��������DԪ�ص����붡����Һ�з���˫ˮ�ⷴӦ�����ӷ���ʽAl3++3AlO2��+6H2O=4Al��OH��3����
b��Fe2+�л�ԭ�ԣ�����������KMnO4��Һ���飬����������KMnO4��Һ���Ϻ�ɫ��ɫ������Һ����Fe2+�����Ӧ�����ӷ���ʽΪ5Fe2++MnO4��+8H+=5Fe3++Mn2++4H2O��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д� Ŀ�����ϵ�д�
Ŀ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����19.2g ��Cu����������ϡ�����У�����Cu��ȫ��Ӧ����֪��
3Cu+8HNO3��ϡ��=3Cu��NO3��2+2NO��+4H2O��
��1�����ɵ�NO�ڱ�״���µ������
��2������ԭ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ԭ����ԭ���ԭ���ǵ绯ѧ��������Ҫ���ݡ�ij��ȤС��������̽�ʵ�飺
(1)������ͼlΪijʵ��С������������ԭ��Ӧ��Ƶ�ԭ���װ�ã��÷�Ӧ�����ӷ���ʽΪ_______����Ӧǰ���缫������ȣ�һ��ʱ������缫�������12g��������ͨ��______mol���ӡ�
(2)�����������䣬����CuCl2��Һ��ΪNH4Cl��Һ��ʯī�缫��Ӧʽ_______��

(3)������ͼ�������������䣬�������Ż�����ͭ������ʯī������n�ͣ���װ������ͭ��������ʯī(2)�缫�Ϸ����ķ�ӦʽΪ______________��
(4)����ͼ��װ���и�Ϊ����400 mLCuSO4��Һ��һ��ʱ�����ij�缫��������1.28 g�����ʱ��Һ��������Ũ��Ϊ__________����������Һ����ޱ仯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ��R����̬�⻯��Ļ�ѧʽΪHxR���ڱ�״���£�8.5��HxR����������5.6L����5.1��HxR����ͨ��200ml0.75mol/L��CuSO4��Һ��ǡ����ȫ��Ӧ����֪Rԭ�Ӻ���������������������
��1��HxR����Է�������Ϊ ��
��2����ͨ��������x��ֵ����ȷ��RԪ�ص����ƣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��������У���ȷ����( )

A. ����ͼ�ٿ��ж�����Ӧ����H<0
B. ����ͼ�ڣ���ȥCuSO4��Һ�е�Fe3�����ɼ���CuO����pH��3��5
C. ͼ�ۿɱ�ʾѹǿ(p)�Է�Ӧ2A(g)��2B(g) ![]() 3C(g)��D(s)��Ӱ��
3C(g)��D(s)��Ӱ��
D. ͼ��Ϊˮ�ĵ���ƽ������ͼ������A�㵽C�㣬�ɲ�����ˮ�м�������NaOH����ķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijһ��������4��������ɣ�������109���ļ�����˵����ʷ��������ٺ�����NH2�� ��COOH���������������ֱ�Ϊ�� ��
A. 105����105����105��
B. 110����110����110��
C. 4����4����113��
D. 4����4����109��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������ȷ���ǣ� ��
A��ͬϵ��������ƵĻ�ѧ����
B��ͬ���칹��������ƵĻ�ѧ����
C��������������һ����CH2��ԭ���ŵ������л���ض���Ϊͬϵ��
D����Է���������ȵ������л���ض���ͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤����ʵ�����Ʊ�Cl2�Ĺ����л���ˮ������HCl�ӷ���������ͬѧ�������ͼ��ʾ��ʵ��װ�ã���Ҫ��ش����⣺ 
��1������ݼ�ͬѧ����ͼ��������Ӧ��װ�ã��ӿ�˳��b�� �� �� �� ��a��
��2��U�ι�����ʢ�Լ�Ϊ ��
��3��װ�â���CCl4�������� ��
��4����ͬѧ��Ϊ��ͬѧ��ʵ����ȱ�ݣ�����֤������ͨ��AgNO3��Һ�е�����ֻ��һ�֣�Ϊ��ȷ��ʵ����۵Ŀɿ��ԣ�֤������ͨ��AgNO3��Һ�е�����ֻ��һ�֣���ͬѧ�����װ�â�֮��������һ��װ�âۣ����۲쵽����ʱ��ȷ��������ȷ����ͬѧ������ͬѧ��Ƶ�װ�ú����������װ�ã�ֻ�轫ԭ���ձ��е�AgNO3��Һ����������Һ������Ϊ�ɽ���Һ���� �� ����۲쵽��������֤����Cl2ʱ��HCl�ӷ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£�CO��CO2�Ļ�����干8.96 L������Ϊ12.8 g����������������ʵ���֮��Ϊ_______mol������CO2Ϊ_______mol��CO����������_______����������Ħ������Ϊ_______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com