
 现有部分前四周期元素的性质、原子结构如下表:
现有部分前四周期元素的性质、原子结构如下表:| 元素 编号 | 元素性质、原子结构 |
| A | 第三周期中的半导体材料 |
| B | L层s电子数比p电子数少1 |
| C | 第三周期主族元素中其电负性最大 |
| D | 元素的2p轨道无空轨道,且有两个单电子 |
 ,含有σ键和π键个数比为1:2,在氨分子中由于氮原子的价层电子对数为
,含有σ键和π键个数比为1:2,在氨分子中由于氮原子的价层电子对数为| 5+3 |
| 2 |
 ;1:2;四面体;氨气与水反应程度大,且为极性分子与水分子相同,以及与水分子之间形成氢键;Cl2、O2的极性与水不同,但Cl2能与水反应;
;1:2;四面体;氨气与水反应程度大,且为极性分子与水分子相同,以及与水分子之间形成氢键;Cl2、O2的极性与水不同,但Cl2能与水反应;| 5+3 |
| 2 |
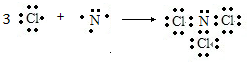 ,
,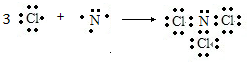 ;
;

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼. | 常温下单质能与水剧烈反应生成氢气. | 第三周期元素的简单离子中半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将浓度为0.1mol?L-1HF溶液加水不断稀释过程中,c(H+)和c(OH-)都会减小 |
| B、常温下,为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的PH,若PH>7,则H2A是弱酸;若PH<7,则H2A是强酸 |
| C、将SO2通入一定量的KOH溶液,所得溶液呈中性,该溶液中一定含KHSO2 |
| D、用0.2000mol?L-1NaOH标准溶液滴定浓度均为0.1mol?L-1的HCl与CH3COOH的混合液,至中性时,溶液中的酸恰好被完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol NaCl中,Na+的核外电子总数为10NA |
| B、1molFe与过量的稀HNO3反应,转移2NA个电子 |
| C、0.1mol?L?1Na2SO4液含有0.1NA个SO42- |
| D、常温常压下,22.4L氯气与足量镁粉充分反应,生成MgCl2 2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com