
| A. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O | |
| B. | CH3CHBrCH3+NaOH$→_{△}^{乙醇}$CH3CH═CH2↑+NaBr+H2O | |
| C. | 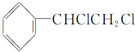 +2NaOH$→_{△}^{乙醇}$ +2NaOH$→_{△}^{乙醇}$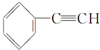 +2NaCl+2H2O +2NaCl+2H2O | |
| D. | 2CH3OH$→_{△}^{浓硫酸}$CH3-O-CH3+H2O |
分析 有机物中脱去一个或几个小分子(如水、卤化氢等分子),而生成不饱和(碳碳双键或三键或苯环状)化合物的反应,叫做消去反应,结合有机物结构判断.
解答 解:A.乙醇与浓硫酸共热至170℃发生分子内脱水生成乙烯,属于消去反应,故A错误;
B.卤代烃在氢氧化钠的醇溶液中发生消去反应,2-溴丙烷与氢氧化钠的乙醇溶液反应生成丙烯,属于消去反应,故B错误;
C.卤代烃在氢氧化钠的醇溶液中发生消去反应,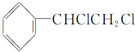 在氢氧化钠醇溶液的作用下分子内脱去了HCl生成了苯乙炔,属于消去反应,故C错误;
在氢氧化钠醇溶液的作用下分子内脱去了HCl生成了苯乙炔,属于消去反应,故C错误;
D.甲醇与浓硫酸共热发生分子间脱水生成二甲醚,属于取代反应,故D正确.
故选D.
点评 本题考查有机反应类型,难度不大,注意对有机反应概念的理解,注意从反应中反应物和生成物的结构理解有机反应类型.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中Cu2S只做还原剂 | |
| B. | 参加反应的n(Cu2S):n(HNO3)=1:5 | |
| C. | 产物n[Cu(NO3)2]:n[CuSO4]=1:1 | |
| D. | 1 molCu2S参加反应时有10 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
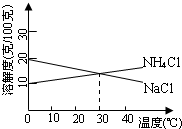 NaCl和NH4Cl共同存在时的溶解度曲线如图所示,利用NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,有利于析出NH4Cl.以下说法中正确的是( )
NaCl和NH4Cl共同存在时的溶解度曲线如图所示,利用NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,有利于析出NH4Cl.以下说法中正确的是( )| A. | 0℃时,饱和的NaCl和NH4Cl混合溶液中,NaCl的物质的量浓度是NH4Cl的2倍 | |
| B. | 30℃时,饱和的NaCl和NH4Cl混合溶液中,两者的物质的量浓度相等 | |
| C. | 通入的气体可能是NH3,控制在0~10℃结晶出NH4Cl | |
| D. | 通入的气体可能是CO2,控制在30~40℃结晶出NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 71g氯气与过量的FeCl2溶液完全反应转移的电子数为2NA | |
| B. | 1 mol甲基(-14CH3)所含中子数为9NA | |
| C. | 在标准状况下,2.24L四氯甲烷所含的分子数为0.1NA | |
| D. | 2L 0.1mol/L 的醋酸钠溶液中,所含离子总数是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1•min-1 | B. | 1.2mol•L-1•min-1 | ||
| C. | 6mol•L-1•min-1 | D. | 0.41mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| C、O、Si第一电离能 | 离子半径Cl-、Na+、O2- | 熔点 | 电负性 |
| Si<C<O | Cl->O2->Na+ | CO2<SiO2 | Cl>Si |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com