
在pH=1且含有大量Fe2+和NH4+的溶液中,能大量存在的阴离子是( )
|
| A. | SO42﹣ | B. | NO3﹣ | C. | OH﹣ | D. | HCO3﹣ |
| 离子共存问题.. | |
| 专题: | 离子反应专题. |
| 分析: | pH=1,显酸性,与Fe2+和NH4+不发生反应的离子,可大量共存,即离子之间不能结合生成水、沉淀、弱电解质,不能发生氧化还原反应等. |
| 解答: | 解:A.不与溶液中的离子发生反应,则能大量共存,故A正确; B.因Fe2+、H+、NO3﹣发生氧化还原反应,不能大量共存,故B错误; C.因H+、OH﹣结合生成水,不能大量共存,故C错误; D.H+、HCO3﹣结合生成水和气体,不能大量共存,故D错误; 故选A. |
| 点评: | 本题考查离子的共存,为高频考点,把握离子之间的反应及习题中的信息为解答的关键,侧重氧化还原反应及复分解反应的考查,题目难度不大. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
如图1,溶液A中可能含有Mg2+、Cu2+、Al3+、Fe2+四种阳离子,B为淡黄色固体,旋开E后,有气体放出和白色沉淀生成,淡黄色固体的物质的量与产生沉淀的质量关系如图2。
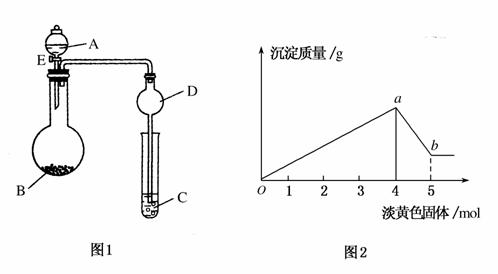
(1)则溶液中含有的阳离子有________。
(2)写出图2曲线a~b段反应的离子方程式________________,________________。
(3)A溶液中存在的阳离子的物质的量浓度之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。

填写下面空白。
(1)图中标号处需加入的相应物质分别是①________;②________;③________;④________;⑤________。
(2)写出①处发生反应的离子方程式_____________________ _____________;写出③处发生反应的化学方程式___________。
(3)铁红的化学式为________________________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红________________;氧化铜________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
50 g浓度为c mol·L-1,密度为ρ g·cm-3的氨水中加入一定量的水稀释成0.5c mol·L-1,则加入水的体积为( )
A.小于50 mL B.等于50 mL
C.大于50 mL D.等于50/ρ mL
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中现用Fe与盐酸反应制取2.24 L H2(标准状况下)。
(1)消耗Fe的物质的量为多少?
(2)如果选用所贴标签为2.0 mol·L-1的盐酸,至少需该盐酸多少升?
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室保存下列试剂的方法不正确的是( )
|
| A. | 钠保存在煤油中 |
|
| B. | 用棕色试剂瓶盛放新制的氯 |
|
| C. | 用带玻璃塞的试剂瓶盛放NaOH溶液 |
|
| D. | 向盛放氯化亚铁溶液的试剂瓶中加少量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 钠和冷水反应:Na+2H2O=Na++2OH﹣+H2↑ |
|
| B. | AlCl3溶液中加入过量的浓氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
|
| C. | 用小苏打治疗胃酸过多:CO32﹣+2H+=H2O+CO2↑ |
|
| D. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。某科研小组用该原理处理污水,设计的装置如图所示。下列说法正确的是( )

A.为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液
B.甲装置中Fe电极的反应为Fe-3e-===Fe3+
C.为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2
D.当乙装置中有1.6 g CH4参加反应时,C电极理论上生成气体的体积在标准状况下为4.48 L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分类合理的是
A.氧化物:CO2 NO SO2 H2O
B.碱:NaOH KOH Ba(OH)2 Na2CO3
C.铵盐:NH4Cl NH4NO3 (NH4)2SO4 NH3·H2O
D.酸:NaHSO3 HCl H2SO4 HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com