
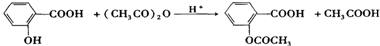


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 放电 |
| A、放电时,锂离子向负极移动 |
| B、放电时,负极上反应的物质是锂,正极上反应的物质是V2O5 |
| C、放电时,负极的电极反应为Li-e-=Li+ |
| D、充电时,V2O5在阴极被还原 |
查看答案和解析>>
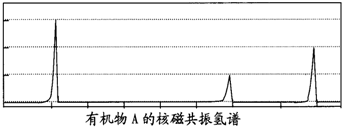
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
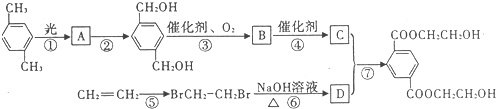
 卡托普列(Captopril)临床用于治疗高血压和充血性心力衰竭.它最有价值的合成路线为:
卡托普列(Captopril)临床用于治疗高血压和充血性心力衰竭.它最有价值的合成路线为: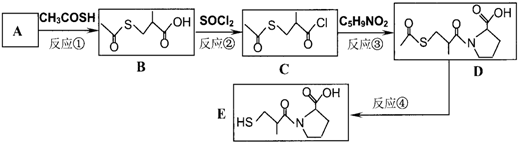
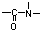 能在碱性条件下水解.则1molE最多能与
能在碱性条件下水解.则1molE最多能与查看答案和解析>>
科目:高中化学 来源: 题型:
| 操 作 | 结 论 | |
| 甲 | 分别滴在火柴梗上 | 变黑者为浓硫酸 |
| 乙 | 分别加入金属铝片 | 产生刺激性气味者为浓硫酸 |
| 丙 | 分别加入到盛水的试管中 | 放热很显著的为浓硫酸 |
| 丁 | 分别用玻璃棒蘸浓氨水靠近盛酸的瓶口 | 冒白烟的为浓硫酸 |
| 戊 | 分别加到CuSO4?5H2O 晶体中 | 变白者为浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| H+ |
| 转换 |
2- 7 |
| Fe2+ |
| 还原 |
| OH- |
| 沉淀 |
2- 4 |
2- 7 |
| 10 |
| 11 |
| A、溶液颜色保持不变,说明上述可逆反应达到平衡状态 |
| B、若用绿矾(FeS04?7H20)(M=278)作还原剂,处理1 L废水,至少需要917.4 g |
| C、常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D、常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、苯在常温下与浓硝酸混合(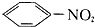 ) ) |
| B、将乙烯通入到水中(CH3CH2OH) |
C、甲苯与氯气在氯化铁催化下反应( ) ) |
| D、乙醇在银催化下加热与氧气反应(CH3CHO) |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com