
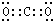 .
.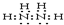
分析 p能级电子数不超过6,A原子最外层p能级的电子数等于次外层的电子数总数,则A的核外电子排布为1s22s22p2,应为C元素;
D单质是一种重要的半导体材料,为Si元素;
EB2是形成酸雨的主要物质,E与B的质量比为1:1,形成酸雨的主要成分是二氧化硫和氮氧化物,只有SO2中S、O元素的质量比为1:1,所以E是S元素、B是O元素;
B元素可分别与A、C、D、E生成RB2型化合物,且A、B、C属于同一周期元素,B和C能形成RB2型化合物,则C是N元素;
结合元素对应原子的结构、单质以及化合物的性质解答该题.
解答 解:p能级电子数不超过6,A原子最外层p能级的电子数等于次外层的电子数总数,则A的核外电子排布为1s22s22p2,应为C元素;
D单质是一种重要的半导体材料,为Si元素;
EB2是形成酸雨的主要物质,E与B的质量比为1:1,形成酸雨的主要成分是二氧化硫和氮氧化物,只有SO2中S、O元素的质量比为1:1,所以E是S元素、B是O元素;
B元素可分别与A、C、D、E生成RB2型化合物,且A、B、C属于同一周期元素,B和C能形成RB2型化合物,则C是N元素;
(1)通过以上分析知,B、C、D分别是氮、硅、硫元素,故答案为:氮;硅;硫;
(2)D是Si元素,其价电子为最外层电子,最外层3s、3p能级上分别含有两个电子,所以价电子排布式为3s23p2,故答案为:3s23p2;
(3)A、B元素单质完全反应生成二氧化碳,二氧化碳分子中每个O原子和C原子形成两个共用电子对,该分子中所有原子都达到8电子结构,电子式为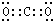 ,故答案为:
,故答案为: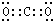 ;
;
(4)C的常见氢化物是氨气,氨气分子中N原子价层电子对个数是4且含有一个孤电子对,所以空间构型是三角锥形,另一种氢化物是肼,肼分子中每个氮原子连接两个H原子,氮原子之间共用一对电子,且每个N原子还含有一个孤电子对,所以其电子式为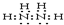 ,故答案为:三角锥形;
,故答案为:三角锥形;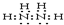 ;
;
(5)B是O元素,其常见氢化物是水,水分子中O原子价层电子对个数是4,所以O原子采用sp3杂化,其VSEPR模型是四面体,故答案为:sp3;四面体;
(6)同一周期元素,元素的电负性随着原子序数增大而增大,所以电负性Si<S,故答案为:Si<S.
点评 本题考查位置结构性质的相互关系及应用,涉及元素周期律、电子式、原子杂化方式判断、粒子空间构型判断等知识点,综合性较强,明确元素周期律、价层电子对互斥理论即可解答,难点是孤电子对个数的判断.


科目:高中化学 来源: 题型:选择题
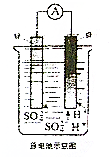 如图所示,将铜片、锌片用导线连接后置于同一稀硫酸中形成原电池,下列相关叙述正确的是( )
如图所示,将铜片、锌片用导线连接后置于同一稀硫酸中形成原电池,下列相关叙述正确的是( )| A. | 锌片是原电池负极 | B. | 溶液逐渐变为蓝色 | ||
| C. | H+在负极得到电子被还原 | D. | 锌片越纯,锌片上产生的气泡越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-+OH-+2H+═HCO3-↑+H2O | B. | CO32-+2OH-+3H+═HCO3-+2H2O | ||
| C. | CO32-+2OH-+4H+═CO2↑+3H2O | D. | CO32-+OH-+3H+═CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
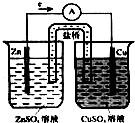 如图是铜锌原电池,又称丹尼尔电池.请回答:
如图是铜锌原电池,又称丹尼尔电池.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙烯的结构简式:CH2CH2 | B. | H2O2的结构式:H-0-0-H | ||
| C. | 氮气的电子式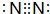 | D. | CH4分子的比例模型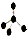 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H和${\;}_{1}^{2}$H互为同位素 | B. | 淀粉和纤维素互为同分异构体 | ||
| C. |  和 和 属于同一种物质 属于同一种物质 | D. | CH4和C2H6互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溴苯中混有溴,加入氢氧化钠溶液,振荡、静置、分液 | |
| B. | 苯中混有苯酚,加浓溴水后过滤 | |
| C. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯中混有乙酸,可选用饱和Na2CO3溶液,振荡、静置、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沾有苯酚的试管,用碳酸钠溶液洗涤 | |
| B. | 做过银镜反应的试管,用稀氨水洗涤 | |
| C. | 沾有油脂的试管,用氢氧化钠溶液洗涤 | |
| D. | 做过制取酚醛树脂实验的试管,用酒精浸泡后再清洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com