
| A. | 液态氧--化合物 | B. | 纯净盐酸--纯净物 | ||
| C. | Na2O--碱性氧化物 | D. | NaHSO4--含氧酸 |
分析 A.不同元素组成的纯净物为化合物,同种元素组成的纯净物为单质;
B.一种物质组成的为纯净物,不同物质组成的为混合物;
C.和酸反应生成盐和水的氧化物为碱性氧化物,反应为复分解反应;
D.含氧酸根离子和金属离子构成的化合物为含氧酸盐,水溶液中电离出的阳离子全部是氢离子的化合物为酸;
解答 解:A.液态氧是一种元素组成的纯净物是单质,故A错误;
B.纯净的盐酸是氯化氢气体的水溶液,属于混合物,故B错误;
C.Na2O和酸反应生成盐和水,符合碱性氧化物的概念,属于碱性氧化物,故C正确;
D.NaHSO4是钠离子和硫酸氢根离子构成的化合物是盐,不是含氧酸,故D错误;
故选C.
点评 本题考查了物质分类方法和物质组成判断,理解概念实质、掌握基础知识是解题关键,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属铁与盐酸的反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氧化铜与硫酸溶液的反应:O2-+2H+═H2O | |
| C. | CuSO4溶液与Ba(OH)2溶液混合:Cu2++2OH-═Cu(OH)2↓ | |
| D. | 硫酸铝溶液与稀氨水混合:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KOH溶液可以将NH4Cl、NaBr、CuSO4、FeCl3区别开 | |
| B. | C、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开 | |
| C. | 某溶液中加入稀盐酸有无色气体产生,该气体能使澄清石灰水变浑浊,则此溶液中一定含有CO32? | |
| D. | 某溶液中先滴加氯水,再滴加KSCN溶液后显红色,则此溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
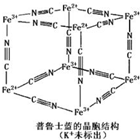 普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )| A. | 化学式可以表示为KFe2(CN)6 | |
| B. | 每一个立方体中平均含有24个π键 | |
| C. | 普鲁士蓝不属于配位化合物 | |
| D. | 每个Fe3+周围与之相邻的Fe2+离子有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
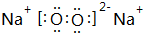
| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
| D | 其基态原子外围电子排布为msnmpn+2 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
| F | 基态F+各能级电子全充满 |
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com