
【题目】已知:将![]() 通入含
通入含![]() 的溶液中两者恰好完全反应,产物中可能有NaCl、NaClO、
的溶液中两者恰好完全反应,产物中可能有NaCl、NaClO、![]() 。温度不同,三者的量也不同。下列说法不正确的是
。温度不同,三者的量也不同。下列说法不正确的是
A.改变温度,当产物中![]() 的物质的量最大时,发生的离子反应为:
的物质的量最大时,发生的离子反应为:![]()
B.某温度下,反应后若溶液中![]() ,发生的离子反应为:
,发生的离子反应为:![]()
C.参加反应的![]() 与NaOH的物质的量关系一定是
与NaOH的物质的量关系一定是![]()
D.改变温度,反应中转移电子的物质的量可能为![]()
科目:高中化学 来源: 题型:
【题目】下述实验方案能达到实验目的的是 ( )
编号 | A | B | C | D |
实验 |
|
|
|
|
实验 | 验证铁钉发生 | 验证Fe电极被保护 | 验证乙炔的还原性 | 验证甲烷与氯气发生 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是( )

A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加入浓硫酸,待冷却至室温后,再将所得混合物加入苯中
C.仪器a的作用是冷凝回流,提高原料的利用率
D.反应完全后,可用仪器a、b蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能用勒夏特列原理解释的是( )
A.H2、I2、HI平衡混合气加压后颜色变深
B.工业上由氢气和氮气合成氨是在较高温度下进行的
C.Fe(SCN)3溶液中加入固体KSCN后颜色变深
D.SO2催化氧化成SO3的反应,往往需要使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种烈化物和两种氧化物。某学习小组在实验用C12和NO制备NOCl并测定其纯度,相关实验(装置略去)如下。请回答:
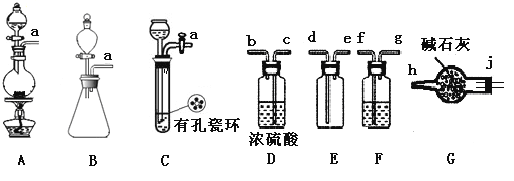
(1)制备Cl2发生装置可______ (填大写字母),反应的离子方程式为_______。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→________(按气流方向,用小写字母表示),若用到F,其盛装药品为_________。
(3)实验室可用下图装置制备亚硝酰氯(NOCl)
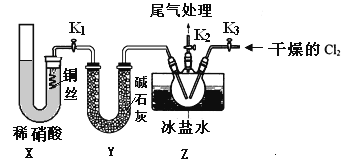
①实验室也可用B装置制备NO,上图X装置的优点为__________(至少写出两点)
②检验装置气密性并装入药品,打开k2,然后再打开____(填“k1”或“k3”),通入一段时间气体,其目的为________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装肖Y,则Z中NOCl可能发生反应的化学方程式为_________
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL.已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,则亚硝酰氯(NOC1)的质量分数为____(用代数式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温下气体反应达到化学平衡,平衡常数K=c(A)·c2(B)/[c2(E)·c(F)],恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
A. 增大c(A)、c(B),K增大
B. 降低温度,正反应速率增大
C. 该反应的焓变为负值
D. 该反应的化学方程式为2E(g)+F(g)![]() A(g)+2B(g)
A(g)+2B(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaNO3和HCl的混合溶液400mL,向混合溶液中逐渐加入过量的Fe粉,如图所示。(反应中HNO3只被还原成NO)下列说法正确的是

A. 硝酸钠的物质的量浓度为2.5mol/L
B. 标况下,反应过程共产生22.4L的气体
C. 整个反应过程中每步转移的电子之和为4mol
D. 将反应后的混合物过滤,滤液蒸发结晶所得固体为 NaCl和FeCl2的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。

(1)A是铅蓄电池的___________极,铅蓄电池正极反应式为___________,放电过程中电解液的密度___________ (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是___________,该电极的电极产物共____________g。
(3)Cu电极的电极反应式是____________,CuSO4溶液的浓度____________(填“减小”、“增大”或“不变”)
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示___________。

a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com