
| A、KSCN |
| B、K2SO4 |
| C、NaOH |
| D、FeCl3 |


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A、反应在前2 s 的平均速率v(CO)=0.080mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时c(Cl2)=0.11 mol?L-1,则正反应为放热反应 |
| C、向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,反应达到平衡前v正>v逆 |
| D、若起始向容器中充入1.0 mol Cl2 和0.9 mol CO,达到平衡时,Cl2的转化率大于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、Mg2+ |
| B、Fe2+、Mg2+ |
| C、Fe2+、NH4+ |
| D、Al3+、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+)?c(A-) |
| c(HA) |
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?? H++CH3COO- | 1.75×10-5 |
| H2CO3 | H2CO3??H++HCO3- HCO3-??H++CO32- | K1=4.4×10-7 K2=4.7×10-11 |
| H2S | H2S??H++HS- HS-??H++S2-[来源:.Com] | K1=1.3×10-7 K2=7.1×10-15 |
| H3PO4 | H3PO4??H++H2PO4- H2PO4-?H++HPO42- HPO42-??H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
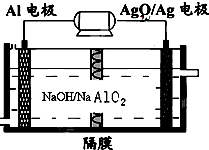 铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示.下列说法正确的是( )
铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示.下列说法正确的是( )| A、电池负极反应式2Ag+2OH--2e-=Ag 2O+H2O |
| B、放电时电池负极附近PH减小 |
| C、电池总反应式2Al+3Ag2O+6H+=2Al3++6Ag+3H2O |
| D、电解液中Na+通过隔膜由右向左移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,78 g Na2O2中含有的阴离子数是2NA |
| B、常温下,l L 0.l mol?L-1NH4NO3溶液中含有的NH4+数是0.l NA |
| C、常温常压下,22.4 L SO2和O2混合气体中含有的氧原子数是2 NA |
| D、铁铝混合物与一定量盐酸反应生成1 mol H2时,转移电子数是2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径呈周期性变化 |
| B、元素的化合价呈周期性变化 |
| C、第一电离能呈周期性变化 |
| D、元素原子的核外电子排布呈周期性变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com