
| A. | 表示物质数量的单位 | |
| B. | 用巨大数量的微粒集体表示物质的量的单位 | |
| C. | 表示物质的质量单位 | |
| D. | 既表示物质的质量又表示物质微粒的数量单位 |
科目:高中化学 来源: 题型:填空题
 将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品. .
.| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铝是一种比较好的耐火材料,它可以用来制造耐火坩埚等实验仪器 | |
| B. | 一般合金的硬度大于它的纯金属成分,合金的熔点低于它的成分金属 | |
| C. | 碳酸钠晶体在干燥空气里容易逐渐失去结晶水变成碳酸钠粉末 | |
| D. | Fe3O4是一种复杂的化合物,俗称磁性氧化铁,常用于制作红色油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
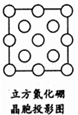 太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.
太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa═CH3COO-+Na+ | B. | H2SO4═H2++SO42- | ||
| C. | FeCl3═Fe2++3Cl- | D. | KClO3═K++3O2-+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾中铝离子水解产生的胶体具有很强的吸附作用而常用于净水 | |
| B. | 地球上99%以上的溴蕴藏在大海中,因此溴被称为“海洋元素” | |
| C. | 目前加碘盐中添加的含碘物质是KI,可用氯水和淀粉溶液鉴定食盐是否加碘 | |
| D. | 为减少污染、提高燃烧效率,可将煤气化或液化获得清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn与稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| B. | 金属铜与稀盐酸反应:Cu+2H+═Cu2++H2↑ | |
| C. | Ca(OH)2溶液与Na2CO3溶液反应:Ca2++CO${\;}_{3}^{2-}$═CaCO3↓ | |
| D. | 氧化铁与稀盐酸反应:Fe2O3+6H+═2Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com