
【题目】下列说法中不正确的是( )
A. 乙烯与苯都能使溴水褪色,但褪色原理不同
B. 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气 5mol
C. 溴水遇到乙醛溶液出现褪色现象,是因为发生了氧化反应
D. ![]() 与
与![]() 互为同分异构体
互为同分异构体
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】把3molP和2.5molQ置于2L密闭容器中,发生如下反应:3P(g)+Q(g)![]()
![]() xM(g)+2N(g),5min后达到平衡,生成N1mol,经测定M的平均速率是0.1mol/(Lmin),下列叙述错误的是( )
xM(g)+2N(g),5min后达到平衡,生成N1mol,经测定M的平均速率是0.1mol/(Lmin),下列叙述错误的是( )
A. P的平均反应速率是0.15mol/(Lmin)
B. Q的转化率是25%
C. Q的平衡浓度是1mol/L
D. x的值为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作、现象和结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 将等体积等浓度的HX和HY与足量的锌反应,收集产生的氢气并记录其体积 | HX收集到的氢气多 | HX是强酸 |
B | 向滴有酚酞的碳酸钠溶液中加入少量的氯化钡固体 | 红色变浅 | 碳酸钠溶液中存在水解平衡 |
C | 向反应FeCl3+3KSCN | 红色变浅 | 增大KCl的浓度,平衡逆向移动 |
D | 常温下分别测量等浓度的K2SO3和KCl溶液的pH | pH:K2SO3>KCl | 非金属性:Cl>S |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系:

下列说法正确的是( )
A. 若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si
B. 若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物
C. 若甲为金属单质,乙为非金属单质,则甲只能是Mg
D. 若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,某容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g)![]() H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
A.升高温度 B.加入催化剂
C.再加入n molCO和n molH2O D.再加入2n molCO2和2n molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物中,在不同条件下,既能发生水解反应和消去反应,又能发生酯化反应并能与金属钠反应放出氢气的是 ( )
①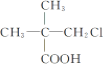 ②
②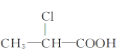 ③
③![]() ④
④
A. ②B. ②③C. ①②D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,1-二环丙基乙烯(![]() )是重要医药中间体,下列关于该化合物的说法错误的是
)是重要医药中间体,下列关于该化合物的说法错误的是
A. 所有碳原子不能在同一平面 B. 能被酸性髙锰酸钾溶液氧化
C. 二氯代物只有3种 D. 生成1 molC8H18至少需要3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:

(1)Na2FeO4中铁元素的化合价为___,高铁酸钠用于杀菌消毒时的化学反应类型为____(填“氧化还原反应”、“复分解反应”或“化合反应”)。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH_____(填“能”或“不能”),理由是___________。
(3)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还____(填字母序号)。步骤③中检验Fe2+全部转化成Fe3+的方法是:__________。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.酸式滴定管;
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_________;己知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_____。
(5)理论上,每获得0.5mol的FeO42-消耗 NaClO的总质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,用NaOH调节0.10mol/LH2C2O4溶液的pH,假设不同pH下均有c(H2C2O4)+c(HC2O4—)+c(C2O42-)=0.10mol/L。使用数字传感器测得溶液中各含碳微粒的物质的量浓度随pH的变化曲线如下图。下列有关分析正确的是

A. 曲线a代表H2C2O4浓度随pH的变化
B. pH从4到6时主要发生的反应离子方程式为2OH-+H2C2O4====2H2O+C2O42-
C. 在曲线a、c交界点有:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
D. 当溶液pH=7时:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H2C2O4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com