
| A. | 液氨 | B. | HCl(气态) | C. | Fe(OH)3胶体 | D. | 固体五氧化二磷 |
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:解答题
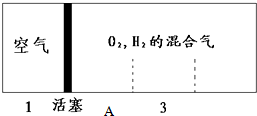 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央A处,则原来H2、O2的体积比最接近于7:2 或4:5;此比例的H2和O2混合气体的平均摩尔质量为8.67g/mol或18.67g/mol.
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央A处,则原来H2、O2的体积比最接近于7:2 或4:5;此比例的H2和O2混合气体的平均摩尔质量为8.67g/mol或18.67g/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +CO2+H2O→NaHCO3+
+CO2+H2O→NaHCO3+ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH2 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol.L-1 | c1 | 1.5 | |
| NH3的体积分数 | φ1 | φ2 | |
| 混合气体的密度/g.L-1 | ρ1 | ρ2 |
| A. | 容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol•L-1•min-1 | |
| B. | 2c1<1.5 | |
| C. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}•(3{c}_{1}-1.5)^{3}}$ | |
| D. | 2ρ1=ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海洋中蕴含的元素有80多种,其中碘的储量可达8×1010t,所以碘被称为海洋元素 | |
| B. | 1774年瑞典科学家舍勒意外地发现一种黄绿色气体,并把它命名为氯气 | |
| C. | 19世纪科学家戴维首次用电解氯化钠溶液的方法制得金属钠 | |
| D. | 钠和钾的合金常温下是液体,可用于快中子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程②中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 从能量转换角度看氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 | |
| D. | 从第③步到第⑤步的目的是为了浓缩富集,提高Br2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com