
分析 由平均摩尔质量=$\frac{m}{n}$来计算,由质量和物质的量的关系列方程解出甲烷的物质的量,再计算混合气体中甲烷的体积和一氧化碳的质量,判断氧气与混合气体的反应程度,进而确定冷却后气体的组成,可计算所得气体的相对分子质量.
解答 解:标准状况下,6.72L气体的物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,混合气体平均摩尔质量为$\frac{6.6g}{0.3mol}$=22g/mol,
设甲烷的物质的量为x,CO的物质的量为y,
则$\left\{\begin{array}{l}{x+y=0.3}\\{16x+28y=6.6}\end{array}\right.$
解得x=0.15mol,y=0.15mol,
则甲烷的体积为0.15mol×22.4L/mol=3.36L,
一氧化碳的质量为0.15mol×28g/mol=4.2g,
氧气的物质的量为$\frac{10.64L}{22.4L/mol}$=0.475mol,
将上述混合气体与标准状况下10.64L的氧气混合点燃,发生CH4+2O2=CO2+2H2O、2CO+O2=2CO2,
0.15 0.3 0.15 0.075
可知氧气过量,反应后混合气体中含有0.3molCO2,0.1molO2,
混合气体的平均相对分子质量为$\frac{0.3mol×44g/mol+0.1mol×32g/mol}{0.4mol}$=41g/mol,
故答案为:22;3.36L;4.2g;41.
点评 本题综合考查物质的量的计算,侧重于学生的计算能力的考查,注意把握相关计算公式列式解答该题,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D |
将铜丝压扁,掰成图案 | 将铅丹、硼酸盐等化合熔制后描绘 | 高温焙烧 | 酸洗去污 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol-NH2(氨基)中所含有的电子数为0.9NA | |
| B. | lmol D218O所含的中子数为12NA | |
| C. | 14 g聚乙烯与聚丙烯的混合物中含H原子的数目为2NA | |
| D. | 一定条件下,0.2 mol SO2与足量O2充分反应,生成的SO3分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 )是制备氯丁橡胶的原料,由于碳碳双键上的氢原子很难发生取代反应,因此它不能通过1,3-丁二烯与Cl2直接反应,如图是2-氯-1,3-丁二烯的合成路线:
)是制备氯丁橡胶的原料,由于碳碳双键上的氢原子很难发生取代反应,因此它不能通过1,3-丁二烯与Cl2直接反应,如图是2-氯-1,3-丁二烯的合成路线:
 结构不稳定
结构不稳定 制备氯丁橡胶的化学方程式:
制备氯丁橡胶的化学方程式: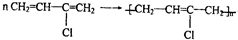 .该反应属于加聚反应(填写反应类型)
.该反应属于加聚反应(填写反应类型)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氟元素是电负性最大的非金属元素,且氟原子的半径小,因此氟单质极易和金属单质反应且把它们氧化到最高价态,如MnF7、VF5、CaF2等.氟元素还可以和氧元素形成氟化物,如OF2等.
氟元素是电负性最大的非金属元素,且氟原子的半径小,因此氟单质极易和金属单质反应且把它们氧化到最高价态,如MnF7、VF5、CaF2等.氟元素还可以和氧元素形成氟化物,如OF2等.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔬菜和粗粮中富含纤维素,纤维素在人体中酶的作用下能水解成葡萄糖 | |
| B. | 混凝法、中和法、沉淀法、氧化还原法是工业处理废水常用的方法 | |
| C. | 阿司匹林具有解热镇痛作用,可预防心脏病发作,也可以作为抗酸药 | |
| D. | 鸡蛋清溶液中加入饱和Na2SO4溶液,有沉淀生成是因为蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
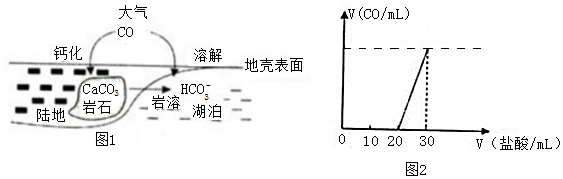
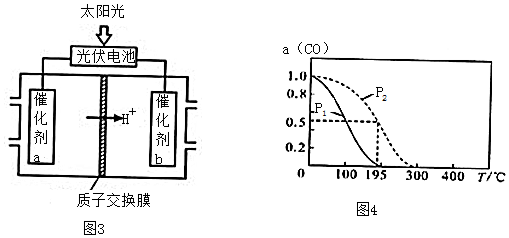
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com