
 .
.分析 A、B、C、D、E五种物质的焰色反应都呈黄色,均含Na元素,A、B与水反应都有气体放出,A与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,则A为Na,B为Na2O2,同时都生成溶液C,则C为NaOH,C与适量CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能够生成D,则D为Na2CO3,E为NaHCO3.
解答 解:A、B、C、D、E五种物质的焰色反应都呈黄色,均含Na元素,A、B与水反应都有气体放出,A与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,则A为Na,B为Na2O2,同时都生成溶液C,则C为NaOH,C与适量CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能够生成D,则D为Na2CO3,E为NaHCO3.
(1)由上述分析可知,B为Na2O2,E为NaHCO3,故答案为:Na2O2;NaHCO3;
(2)A→C的化学方程式为2Na+2H2O=NaOH+2H2↑,标出电子转移的方向和数目: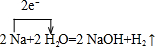 ,
,
故答案为: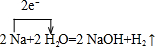 ;
;
(3)C→D的离子方程式:CO2+2OH-=CO32-+H2O,
故答案为:CO2+2OH-=CO32-+H2O;
(4)过氧化钠与水反应生成氢氧化钠与氧气,反应方程式为:2 H2O+2Na2O2=4NaOH+O2↑,
故答案为:2 H2O+2Na2O2=4NaOH+O2↑.
点评 本题考查无机物的推断,涉及Na及其化合物之间的转化,明确焰色反应及氢气具有还原性、氧气具有氧化性推断A、B为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | ① | ② | ③ | ④ |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过加热法除去Na2CO3固体中的NaHCO3 | |
| B. | 通过NaOH溶液除去CO2中的HCl | |
| C. | FeCl3溶液中加入铁粉可以除去溶液中的含有的Fe2+ | |
| D. | 通过饱和碳酸钠溶液除去CO2中混有的SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 128gC60中含有90NA个分子 | |
| B. | 46g NO2和N2O4的混合气体含有的原子数为3NA | |
| C. | 标准状况下,22.4L CCl4所含的分子数为6.02×1023 | |
| D. | 100mL0.1 mol•L-1CaCl2溶液中Cl-的物质的量浓度为0.01 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体中分散质粒子直径大小在1~100 nm之间 | |
| B. | 可以利用丁达尔效应区分胶体和溶液 | |
| C. | 可利用过滤的方法分离胶体和溶液 | |
| D. | 胶体在一定条件下可以稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com