
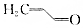
 .则与键线式为
.则与键线式为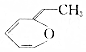 的物质互为同分异构体的是( )
的物质互为同分异构体的是( )| A. |  | B. |  | C. | 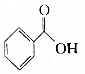 | D. | 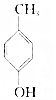 |
科目:高中化学 来源: 题型:推断题
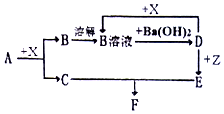 下列物质均为常见物质或它们的溶液,其中A为淡黄色固休,C、X均为无色气体,Z为浅绿色溶液,D为一种常见的强碱.根据它们之间的转化关系(如图),用化学用语回答问题.(部分产物已省略)
下列物质均为常见物质或它们的溶液,其中A为淡黄色固休,C、X均为无色气体,Z为浅绿色溶液,D为一种常见的强碱.根据它们之间的转化关系(如图),用化学用语回答问题.(部分产物已省略) .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

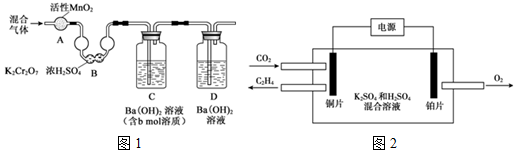
| 温度(℃) CO2 浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 3×10-3 | 0.9×10-2 | 2.7×10-2 |
| t2 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
| t3 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL | B. | 5 mL | C. | 大于5 mL | D. | 小于5 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用前要先检查容量瓶是否漏液 | |
| B. | 用蒸馏水洗涤后必须要将容量瓶烘干 | |
| C. | 为了方便快捷,可以直接在容量瓶内进行固体溶解 | |
| D. | 定容结束后,为了使溶液均匀,手握瓶颈,左右振荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可用于漂白纸浆 | B. | SiO2是良好的半导体材料 | ||
| C. | Na2O2可用作潜水艇O2来源 | D. | Cl2可用于消毒和制造漂白粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com