
下表中所列的是六种短周期元素原子的半径及主要化合价:
|
元素代号 |
A |
B |
C |
D |
E |
G |
|
原子半径/nm |
0.089 |
0.071 |
0.117 |
0.16 |
0.074 |
0.082 |
|
主要化合价 |
+2 |
-1 |
+4,-4 |
+2 |
-2 |
+3 |
(1)C元素在周期表中的位置为 ;E原子的电子填充在 个轨道上,这些电子有 种不同的能量。
(2)B、D、E所代表元素的离子半径从大到小的顺序为 (填离子符号)。
(3)C与E形成的化合物属于 晶体。
(4)周期表中有些元素存在“对角线相似”现象(一种元素的性质常同它右下方相邻的另一种元素具有类似性),请写出A的单质与强碱溶液反应的离子方程式: 。
(5)已知X是与E同族的另一短周期元素,有人认为:H—E键的键能大于H—X键的键能,所以H2E的沸点高于H2X的沸点。你是否赞同这种观点 (填“赞同”或“不赞同”),理由: 。
科目:高中化学 来源: 题型:阅读理解
 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是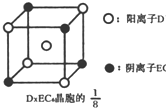
| 元素 | Mn | Fe | |
| 电离 能/kJ?mol-1 |
Ⅰ1 | 717 | 759 |
| Ⅱ2 | 1509 | 1561 | |
| Ⅲ3 | 3248 | 2957 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年云南省部分名校高三第一次联考(11月)理综化学试卷(解析版) 题型:填空题
已知A、B、C、D、E、F六种短周期元素的性质或结构信息如下表,请根据信息回答下列问题。
元素 性质或结构信息
A 单质常温下为固体,难溶于水易于溶CS2。能形成2种二元含氧酸。
B 原子的M层有1个未成对的p电子。核外p电子总数大于7。
C 单质曾被称为“银色的金子”。与锂形成的合金常用于航天飞行器。单质能溶强酸和强碱。
D 原子核外电子层上s电子总数比p电子总数少2个。单质和氧化物均为空间网状晶体,具有很高的熔、沸点。
E 其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一;该元素在三聚氰胺中含量较高。
F 周期表中电负性最大的元素
(1)A原子的最外层电子排布式 ,D原子共有 种不同运动状态的电子。
(2)F与E元素第一电离能的大小关系: > (填元素符号)。
(3)A,B两元素的氢化物分子中键能较小的是 ;分子较稳定的是 。(填分子式)
(4)C单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为_________________。
(5)F与钙可组成离子化合物,其晶胞结构如图所示,该化合物的电子式是 。已知该化合物晶胞1/8的体积为2.0×10-23cm3,求该离子化合物的密度,请列式并计算(结果保留一位小数):_______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
下表中所列的是六种短周期元素原子的半径及主要化合价:
| 元素代号 | A | B | C | D | E | G |
| 原子半径/nm | 0.089 | 0.071 | 0.117 | 0.16 | 0.074 | 0.082 |
| 主要化合价 | +2 | -1 | +4,-4 | +2 | -2 | +3 |
(1)C元素在周期表中的位置为 ;E原子的电子填充在 个轨道上,这些电子有 种不同的能量。
(2)B、D、E所代表元素的离子半径从大到小的顺序为 (填离子符号)。
(3)C与E形成的化合物属于 晶体。
(4)周期表中有些元素存在“对角线相似”现象(一种元素的性质常同它右下方相邻的另一种元素具有类似性),请写出A的单质与强碱溶液反应的离子方程式: 。
(5)已知X是与E同族的另一短周期元素,有人认为:H—E键的键能大于H—X键的键能,所以H2E的沸点高于H2X的沸点。你是否赞同这种观点 (填“赞同”或“不赞同”),理由: 。
查看答案和解析>>
科目:高中化学 来源:2011年陕西省西安市八校联考高考化学模拟试卷(解析版) 题型:解答题
 示)位于该正方体的顶点和面心,该化合物的化学式是______.
示)位于该正方体的顶点和面心,该化合物的化学式是______.
| 元素 | Mn | Fe | |
| 电离 能/kj?mol-1[来源:] | Ⅰ1 | 717 | 759 |
| Ⅱ2 | 1509 | 1561 | |
| Ⅲ3 | 3248 | 2957 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com