
从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量 用来衡量一个国家的石油化工发展水平.B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与 氢元素的质量比为12:1,B的相对分子质量为78.回答下列问题:
(1)A的电子式 B的结构简式
(2)A使溴的四氯化碳溶液褪色的化学反应方程式: ,反应类型: ;
(3)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式: ,
反应类型: 。
科目:高中化学 来源:2015-2016学年湖北省天门、仙桃、潜江市高二下学期期末化学试卷(解析版) 题型:选择题
有关营养物质的说法正确的是
A.在淀粉与稀硫酸共热后的溶液中,滴加银氨溶液,检验水解产物中的葡萄糖
B.纤维素在人体内可水解生成葡萄糖,进而被氧化为二氧化碳和水,释放能量
C.油脂的水解在碱性条件下可生产肥皂,在酸性条件下生成甘油和高级脂肪酸
D.蛋白质水解的最终产物是氨基酸;遇重金属盐则发生盐析,稀释后仍能溶解
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一下学期期末化学试卷(解析版) 题型:选择题
下列判断错误的是( )
A. 沸点:NH3>PH3>AsH3
B. 结合质子的能力:OH->CH3COO->Cl-
C. 酸性:HClO4 >H2SO4 >H3PO4
D. 碱性:NaOH >Mg(OH)2 >Al(OH)3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一下学期期末化学试卷(解析版) 题型:选择题
下列离子方程式正确的是( )
A.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
B.Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-
C.用氯化铁溶液腐蚀印刷线路板上的铜:Fe3++Cu=Fe2++Cu2+
D.明矾溶液与足量的氢氧化钡溶液混合:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一下学期期末化学试卷(解析版) 题型:选择题
W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水,向一定量的W的最高价氧化物对应的水化物溶液中逐滴加入XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
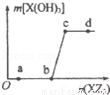
A. d点对应的溶液中:K+、NH4+、CO32﹣、I﹣
B. c点对应的溶液中:Ag+、Ca2+、NO3﹣、Na+
C. b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
D. a点对应的溶液中:Na+、K+、SO42﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下学期期末化学试卷(解析版) 题型:选择题
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol/L。下列判断正确的是( )
xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol/L。下列判断正确的是( )
A.x =1
B.A的平均反应速率为0.3mol/(L·s)
C.B的转化率为60%
D.若混合气体的密度不再改变时,该反应一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下学期期末化学试卷(解析版) 题型:选择题
将铁片和碳棒按图示方式插入硫酸铜溶液中,电流计指针发生偏转。下列针对该装置的说法,正确的是( )
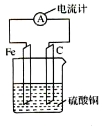
A.碳棒是负极
B.该装置能将电能转化为化学能
C.外电路中电流由铁片流出经过电流计流向碳棒
D.该装置的总反应为:Fe + Cu2+ = Fe2+ + Cu
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西钦州市高二下学期期末化学B卷(解析版) 题型:填空题
聚甲基丙烯酸羟乙酯的结构简式为 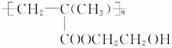 ,它是制作软质隐形眼镜的材料。请写出下列有关反应的化学方程式:
,它是制作软质隐形眼镜的材料。请写出下列有关反应的化学方程式:
(1)由甲基丙烯酸羟乙酯制备聚甲基丙烯酸羟乙酯___________________________________。
(2)由甲基丙烯酸制备甲基丙烯酸羟乙酯___________________________________________。
(3)由乙烯制备乙二醇_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下学期期末化学试卷(解析版) 题型:简答题
硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 、电子数为 。
(2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是 。
(6)在硅酸盐中,SiO4- 4四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 ,Si与O的原子数之比为 ,化学式为 。
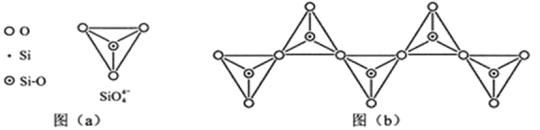
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com