
����Ŀ����ˮ����ȡ֮�����Ļ�ѧ��Դ���Ӻ�ˮ�п���ȡ���ֻ���ԭ�ϣ���ͼ��ij�������Ժ�ˮ��Դ�ۺ����õ�ʾ��ͼ�� 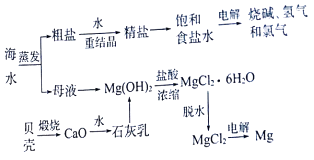
�Իش��������⣺
��1��ʵ�����ォ�����Ƴɾ��εĹ����У����˵IJ������õ����������������������ǣ� �� ����Ҫ�IJ��������У� ��
��2�������к���Ca2+��Mg2+��SO42�������ʣ����ƺ�ɵ�NaCl������Һ������ʱͨ������Һ�У��ټ��������BaC12��Һ���ڹ�����NaOH��Һ���۹�����Na2CO3��Һ���������Լ�˳��Ϊ����д��ţ����������Һ������������Һ�����ԣ���д�������������ܷ�����Ӧ�����ӷ���ʽ�� ��
��3����ˮ��ȡʳ�κ��ĸҺ����K+��Na+��Mg2+�������ӣ������ӷ�Ӧ�ĽǶȿ��ǣ���ĸҺ�����ʯ���鷢����Ӧ�����ӷ���ʽ�� ��
��4�������ˮ�Ȼ�þ��ȡþ�Ļ�ѧ����ʽΪ �� ��þ������ȴ��Ϊ����þ��þ��������Ar����Χ����ȴ�����ɣ� ��
���𰸡�
��1��������ʹ����Һ���ز���������©�����ձ���©��
��2���ڢ٢ۻ�٢ڢۣ�H++OH���TH2O��2H++CO32���TH2O+CO2��
��3��Ca��OH��2+Mg2+�TMg��OH��2+Ca2+
��4��MgCl2�����ڣ� ![]() ?Mg+Cl2��������Mg�������е���������
?Mg+Cl2��������Mg���������������
���������⣺��ˮ�����õ����κ�ĸҺ�����μ���ˮ�ܽ⣬�ؽᾧ�õ����Σ�ĸҺ�м������ñ����������ɵ�����������ˮ�õ�ʯ���飬����þ��������������þ���������˵õ������м��������ܽ⣬����Ũ������ȴ�ᾧ�õ��Ȼ�þ���壬���Ȼ��������ȷֽ���ˮ�õ��Ȼ�þ���壬ͨ���������Ȼ�þ����þ����������1��ʵ�����ォ�����Ƴɾ��εĹ����У����˵IJ������õ�����������������������������ʹ����Һ���ز���������©��������Ҫ�IJ����������ձ���©�������Դ��ǣ�������ʹ����Һ���ز���������©���� �ձ���©������2��SO42����Ca2+��Mg2+�ȷֱ���BaCl2��Һ��Na2CO3��Һ��NaOH��Һ��Ӧ���ɳ���������ͨ�����˳�ȥ��Na2CO3��Һ�ܳ�ȥ������BaCl2��Һ�������ܳ�ȥ������Na2CO3��Һ��NaOH��Һ������Ӧ�ȼ�BaCl2��Һ�ټ�Na2CO3��Һ�����������ᣬ������ȷ˳��Ϊ�ڢ٢ۻ�٢ڢۣ���NaOH��Na2CO3�������������ᷴӦ���������Һ������������Һ�����ԣ��������ӷ���ʽΪ��H++OH���TH2O��2H++CO32���TH2O+CO2�������Դ��ǣ��ڢ٢ۻ�٢ڢۣ�H++OH���TH2O��2H++CO32���TH2O+CO2������3��ĸҺ����K+��Na+��Mg2+�������ӣ���ĸҺ�����ʯ���飬��þ���ӷ�Ӧ����Ӧ�����ӷ���ʽΪ��Ca��OH��2+Mg2+�TMg��OH��2+Ca2+ �� ���Դ��ǣ�Ca��OH��2+Mg2+�TMg��OH��2+Ca2+����4���������MgCl2�ķ�Ӧ��ѧ����ʽΪ��MgCl2�����ڣ� ![]() Mg+Cl2������þ������ȴ��Ϊ����þ��þ��������Ar����Χ����ȴ������Mg�������е��������������Դ��ǣ�MgCl2�����ڣ�
Mg+Cl2������þ������ȴ��Ϊ����þ��þ��������Ar����Χ����ȴ������Mg�������е��������������Դ��ǣ�MgCl2�����ڣ� ![]() Mg+Cl2��������Mg�������е�����������
Mg+Cl2��������Mg�����������������


 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���ߢ�ֱ��ʾ����A������������ø����������������P����������仯���̡��������������ȷ����
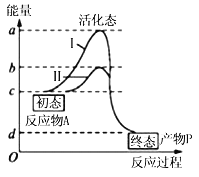
A. ad�α�ʾ�����������£�����A��������P��Ҫ�Ļ��
B. ����ø����Ϊ���������÷�Ӧ����b�������Ͻ������ƶ�
C. �������ӷ�Ӧ��A��������ͼ�����ߵ�ԭ����״�������ı�
D. �����ߢ�Ϊ����ø�������µ����ߣ��ı�ø����������b�������Ͻ������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼����������Ϊ21��4�ı���������ͬ���칹�����ĿΪ�� ��
A.7
B.8
C.9
D.10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¶��ܼӿ췴Ӧ���ʵ���Ҫԭ���ǣ� ��
A. ����������������� B. ���ͻ���Ӱٷ���
C. ���ӻ���Ӱٷ��� D. ���ͷ�Ӧ����Ҫ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ұ��һ�����������ַ������ٽ�̿�� ��ˮú������H2��CO���� �ۻ��ý����û����ܵ�ⷨ�������ַ����ڹ�ҵ�Ͼ���Ӧ�ã��Ŵ��У������տ�ȸʯ��ͭ������ʪ����ͭ���ִ��У��������ȷ��������������ӹ�±ʯ����þ�������ǵ�ұ�������ķ���������ȷ���ǣ� ��
A.������
B.������
C.������
D.����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ܡ��������ʷdz����ƣ����ǵĻ�����Ӧ��ʮ�ֹ㷺���ش��������⣺
��1����̬��ԭ�ӵļ۵����Ų�ʽΪ__________�������ܡ����Ļ�̬ԭ�Ӻ���δ�ɶԵ�����������________��
��2��CoCl2���ڰ�ˮ��ͨ��������ɴ���Һ�нᾧ���Ȼ�ɫ��[Co(NH3)6]Cl3�������������������������_________��������ӵļ۲���ӶԻ���ģ��________��
��3������������CO�����γ��ʻ������Fe(CO)5��Ni(CO)4��Fe(CO)5���۵�Ϊ253K���е�Ϊ376K����Ni(CO)4�������ھ���____________��1mol Ni(CO)4���е���λ����ĿΪ_______��
��4��NiO��FeO�ľ���ṹ�������Ȼ��Ƶ���ͬ��Ni2����Fe2�������Ӱ뾶�ֱ�Ϊ69pm��78 pm�����۵�NiO__________FeO����������������������������ԭ����_____________��
��5��Fe3O4�����У�O2�����ظ����з�ʽ��ͼ��ʾ�������з�ʽ�д���������1��3��6��7��O2��Χ�ɵ����������϶��3��6��7��8��9��12��O2��Χ�ɵ����������϶��Fe3O4����һ���Fe3+��������������϶�У���һ��Fe3+��Fe2+��������������϶�У���Fe3O4�����У����������϶����O2����֮��Ϊ___________����___________%�����������϶û�������������Fe3O4��������8��ͼʾ�ṹ��Ԫ�������ܶ�Ϊ5.18g/cm3����þ�������a= _______________pm����д���������ʽ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���淴Ӧ��N2(g)+3H2(g) ![]() 2NH3 (g)������һ������Ӧ���ȵĿ��淴Ӧ�������Ӧ���ܱ������н��У����й��ڴ˷�Ӧ��˵���д������
2NH3 (g)������һ������Ӧ���ȵĿ��淴Ӧ�������Ӧ���ܱ������н��У����й��ڴ˷�Ӧ��˵���д������
A. ���߷�Ӧ��ϵ���¶ȣ���ʹ��Ӧ���ʱ��
B. �÷�Ӧ��N2������100%ת��ΪNH3
C. �÷�Ӧ�ﵽƽ��״̬ʱ��N2��H2��NH3���ߵ�Ũ��һ�����
D. Ϊ�����H2��ת���ʣ����ʵ����N2��Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������״̬�£��ܵ���ĵ������
A. ϡ���� B. Һ̬�Ȼ��� C. ͭ D. �����Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʡ����ӵ�����ʽϿ��������ơ�����β���ѳ�Ϊ��Ҫ�Ŀ�����Ⱦ����ִ���н�ͨ�ɵ���NOx��CO���س������ұ����Ѿ��з����⻯ѧ������Ⱦ��DZ��Σ�ա�
��1��ij�о���ѧϰС����һ����ʵ�����жԹ⻯ѧ�����γɽ�����ģ��ʵ�顣�����������Ҫ�ɷ�ΪCxHy(��)��NO��NO2��O3��PAN (CH3COOONO2)���������ʵ����Ũ����ʱ��ı仯����¼����ͼ������ͼ�����ݣ����������У����������_____________
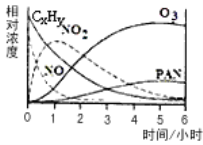
A��NO����ʧ�����ʱ�CxHy�� B��NO����NO2
C��CxHy��NO2��������PAN��O3 D��O3����PAN
��2��������ȼ������ʱ�����ĸ��»�����N2��O2�ķ�Ӧ��N2(g)+O2(g) 2NO(g)���ǵ�������β���к���NO��ԭ��֮һ��
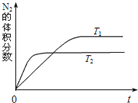
����ͼ��ʾ��T1��T2���ֲ�ͬ�¶��£�һ������NO�����ֽ������N2�����������ʱ��仯��ͼ����ͼ���жϷ�ӦN2(g)+O2(g) 2NO(g)Ϊ___________(��������������������)��Ӧ��
��2000��ʱ�����ݻ�Ϊ2L���ܱ������г���10 mol N2��5 mol O2���ﵽƽ���NO�����ʵ���Ϊ2 mol����2000��ʱ�÷�Ӧ��ƽ�ⳣ��K��____________�����¶��£�����ʼʱ�����������г���N2��O2��Ϊ1 mol����ﵽƽ���N2��ת����Ϊ_______________��
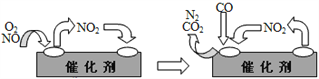
��Ϊ��������β���е��к�����Դ�������Ⱦ����������װβ������װ�á�����װ����װ�к�Pd�ȹ���Ԫ�صĴ����������ڴ�������������������õĻ�������ͼ��ʾ�� д�������仯�е��ܻ�ѧ��Ӧ����ʽ��________________________��
��3��������ϡ��ȼ�գ�ָ�����ڽϴ��/ȼ��(���������͵������)�����µ�ȼ�գݷ�����ʱ����ʱ�����ų�β���е���Ҫ��Ⱦ��ΪNOx��Ϊ����NOx���ŷţ�����������-��ԭ�ʹ�������CxHy(��)����ԭNOxҲ�����������������Ⱦ��
���磺CH4(g)��4NO2(g)��4NO(g)��CO2(g)��2H2O(g)�� ��H1����574 kJ/mol
CH4(g)��4NO(g) ��2N2(g)��CO2(g)+2H2O(g)�� ��H2
��1 mol CH4��ԭNO2��N2�����������зų�������Ϊ867kJ������H2��____________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com