
【题目】聚维酮碘的水溶液是一种常见的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如下 (图中虚线表示氢键)。下列说法不正确的是( )
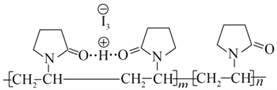
A. 聚维酮的单体是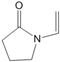 B. 聚维酮分子的聚合度为2m+n
B. 聚维酮分子的聚合度为2m+n
C. 聚维酮在NaOH水溶液中水解可生成 D. 聚维酮和聚维酮碘都是水溶性的
D. 聚维酮和聚维酮碘都是水溶性的
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
0~3 s内,反应速率v(O3)=0.2 mol·L-1·s-1 | 降低温度,平衡常数增大 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是短周期元素,原子半径:D>C>A>B。已知:A、B同周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的3倍。试回答:
(1)写出元素的名称:A__________。
(2)写出由B、D组成的两种化合物的电子式分别为:___________、__________。
(3)A、C的最高价氧化物对应水化物中酸性较强的是__________(写水化物的分子式)。
(4)写出C的氧化物与D的最高价氧化物对应水化物反应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃酚是合成农药的重要中间体,其合成路线如下:
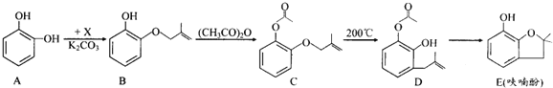
(1)A在空气中久置会由无色转变为棕褐色,其原因是____________,A在核磁共振氢谱中有___________组峰。
(2)B→C的反应类型是_____________________。
(3)已知X的分子式为C4H7Cl。写出A→B的化学方程式:___________________。
(4)要鉴别化合物C和D,适宜的试剂是__________________________。
(5)B的同分异构体很多,符合下列条件的有______种,写出其中能发生银镜反应的同分异构体的结构简式:__________(任写一种)。
①苯的衍生物 ②有两个互为对位的取代基 ③含有酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g)△H<0。测得v正(SO2)随反应时间(t)的变化如图所示,其中在t2时改变了某个条件。下列有关说法正确的是( )

A. t2时改变的条件可能是:升温或缩小容器体积
B. t1时平衡常数K1小于t3时平衡常数K2
C. t1时平衡混合气的![]() > t3时平衡混合气的
> t3时平衡混合气的![]()
D. t1时平衡混合气中的SO3的体积分数等于t3时平衡混合气中SO3的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示。
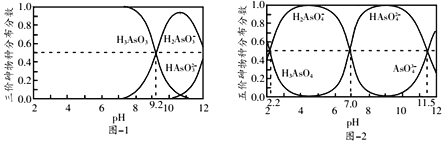
下列说法错误的是( )
A. H3AsO3和Na2HAsO4水溶液可以发生复分解反应
B. H3AsO4水溶液中存在:![]()
C. 向 H3AsO4的溶液中加入一定量的NaOH溶液至pH=5时,![]()
D. 室温下向含0.2mol H3AsO4的溶液中加入12gNaOH固体,所得溶液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表
元素代号 | X | Y | Z | M | R | w |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 | 0.077 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 | +4 -4 |
已知:X是短周期中最活泼的金属,且与R同周期。请用相应的化学用语或者化学符号回答下列问题。
(1)R在元素周期表中的位置为________________。
(2)X与M按原子个数比1:1构成的物质的电子式为_____________;所含化学键类型___________。
(3)X+、Y2-、M2-、R3+离子半径大小顺序为__________________________(用离子符号表示)。
(4)请用电子式表示WY2的形成过程___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________。
(2)利用甲醇燃料电池设计如下图所示的装置:则该装置中b极的电极反应式为_________________________; Zn极为_______极。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( )

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com