
【题目】某溶液中可能合有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉定生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示。下列叙述错误的是
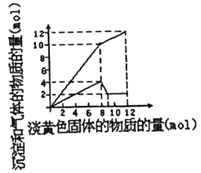
A. 溶液中一定含有的离子是NH4+、Al3+和Mg2+
B. 溶液中肯定不含有Cu2+,可能含有Fe2+
C. 所加的淡黄色固体是Na2O2
D. 溶液中的NH4+和Al3+的物质的量浓度之比3:1
【答案】B
【解析】A.淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象实际为两个图合在一起,较上的是气体,较下的是沉淀,图象中加入8mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe2+和Cu2+,一定有Mg2+、NH4+、Al3+,加入8mol过氧化钠之后,生成气体减小,故加入8mol过氧化钠时,铵根离子完全反应,A正确;B.根据以上分析可知B错误;C.根据以上分析可知C正确;D.根据图像可知溶解氢氧化铝消耗过氧化钠是1mol,1mol过氧化钠产生2mol氢氧化钠,根据Al(OH)3+OH-=AlO2-+2H2O可知氢氧化铝是2mol,所以铝离子是2mol。8mol过氧化钠产生4mol氧气,所以产生的氨气是10mol-4mol=6mol,则铵根是6mol,所以溶液中的NH4+和Al3+的物质的量浓度之比3:1,D正确,答案选B。


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】CO是合成尿素、甲酸的原料。
(1)在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHm0表示。已知石墨和CO的标准燃烧热分别为393.5 kJmol1和283.0 kJmol1 , 则CO(g)的ΔHm0=。
(2)合成尿素的反应:2NH3(g) + CO(g) == CO(NH2)2(g) + H2(g) ΔH =81.0 kJmol1。
①T ℃时,在体积为2 L的恒容密闭容器中,将2 molNH3和1 mol CO混合发生反应,5 min时,NH3的转化率为80%。则0~5 min内的平均反应速率为v(CO)=。
②已知:
温度/K | 398 | 498 | … |
平衡常数(K) | 126.5 | K1 | … |
则:K1126.5(填“>”或“<”);其判断理由是。
③若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示: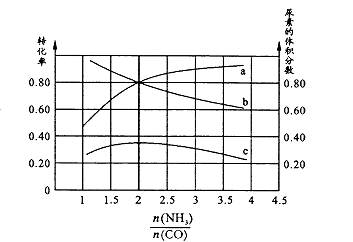
若图中c表示平衡体系中尿素的体积分数,则a表示的转化率。
当 ![]() =时,尿素含量最大;此时,对于该反应既能增大正反应速率又能使平衡正向移动的措施是(写一种)。
=时,尿素含量最大;此时,对于该反应既能增大正反应速率又能使平衡正向移动的措施是(写一种)。
(3)通过人工光合作用可将CO转化成HCOOH。
①已知常温下,浓度均为0.1 molL1的HCOOH和HCOONa混合溶液pH =3.7,则HCOOH的电离常数Ka的值为(已知lg2=0.3)。
②用电化学可消除HCOOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。
Co3+氧化HCOOH的离子方程式为;
忽略体积变化,电解前后Co2+的浓度将(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
以芳香烃A为原料合成有机物F和I的合成路线如下: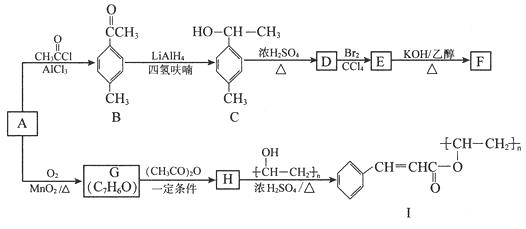
(1)A的分子式为 , C中官能团名称为。
(2)D分子中最多有个原子共平面。
(3)E生成F的反应类型为 , G的结构简式为。
(4)由H生成I的化学方程式为。
(5)符合下列条件的B的同分异构体有种(不考虑立体异构),其中核磁共振氢谱为4组峰且面积比为6∶2∶1∶1的是
(写出其中一种的结构简式)。
①属于芳香化合物 ②能发生银镜反应
(6)已知RCOOH ![]() RCOCl,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备
RCOCl,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备 ![]() 的合成路线。
的合成路线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去NaNO3中少量NaCl、Ca(NO3)2杂质,所用试剂及顺序正确的是( )
A. Na2CO3、AgNO3、HNO3B. AgNO3、Na2CO3、HCl
C. AgNO3、Na2CO3、HNO3D. AgNO3、K2CO3、HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室利用浓盐酸和MnO2制氯气,制备装置中应安装分液漏斗而不能使用长颈漏斗,有关理由叙述错误的是()
A.防止氯气扩散到空气中造成污染
B.便于控制加入盐酸的量
C.长颈漏斗不便于添加液体
D.尽量避免HCl挥发到空气中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是无机物A~M 在一定条件下的转化关系(部分产物及反应条件来列出)。其中,I是由地壳中含量最多的金属元素组成的单质,K是一种红棕色气体, C 是一种强酸。

请填写下列空白:
(1)写出下列物质的化学式:A:___________ E:_____________。
(2)写出反应④的离子方程式:______________________。
写出反应⑦的化学方程式:______________________。
写出反应⑩的化学方程式:______________________。
(3)在反应②、③、⑥、⑧、⑨中,既属于化合反应又属于氧化还原反应的__________________(填写序号) 。
(4)写出检验M溶液中阳离子的方法:______________________。
(5)将化合物D与KNO3、KOH高温共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾),同时还生成KNO2和H2O。写出该反应的化学方程式并用双线桥标出电子转移方向和数目:___________。
(6)ClO2也是绿色净水剂,ClO2制备方法较多,我国科学家探索的新方法是:氯气(Cl2)和固体亚氯酸钠(NaClO2)反应,写出该反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中,能大量共存的是( ) ①酸性溶液中:Fe2+、Al3+、NO ![]() 、Cl﹣、I﹣
、Cl﹣、I﹣
②pH=13的溶液:Na+、CO ![]() 、SO
、SO ![]() 、AlO
、AlO ![]() 、S2﹣
、S2﹣
③水电离出来的c(H+)=10﹣13mol/L的溶液:NH4+、K+、NO ![]() 、S2O
、S2O ![]()
④加入铝片能放出H2的溶液:Na+、HCO ![]() 、Cu2+、SO
、Cu2+、SO ![]()
⑤滴加石蕊试液显红色的溶液:Fe3+、NH ![]() 、Cl﹣、NO
、Cl﹣、NO ![]() .
.
A.①②
B.②③
C.②④⑤
D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上炼铁的主要反应为:Fe2O3 + 3CO![]() 2Fe + 3CO2 。
2Fe + 3CO2 。
(1)该反应中氧化剂是______(填化学式),判断依据是________;被氧化的物质是____(填化学式);若反应中消耗了3 mol CO,则生成______mol Fe。
(2)理论上来看,其中CO可用以下______组(选填a、b、c)物质代替,这些物质在反应中的作用都是_______。
a组: H2 、Cl2 、C b组: H2 、Al、C c组:C 、Al、 Cl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com