
| A. | 化合物:干冰,明矾,烧碱 | B. | 同素异形体:C60,石墨,金刚石 | ||
| C. | 非电解质:乙醇,四氯化碳,氯气 | D. | 混合物:纯净矿泉水,盐酸,漂白粉 |
分析 A.同种元素组成的纯净物为化合物;
B.同种元素组成的不同单质为同素异形体;
C.水溶液中和熔融状态下都不导电的化合物为非电解质;
D.不同物质组成的为混合物;
解答 解:A.干冰是二氧化碳,明矾是硫酸铝钾,烧碱是氢氧化钠,都是不同元素造成的纯净物为化合物,故A正确;
B.C60,石墨,金刚石是碳元素的不同单质,是碳元素的同素异形体,故B正确;
C.乙醇,四氯化碳是非电解质,氯气是单质既不是电解质也不是非电解质,故C错误;
D.纯净矿泉水是矿物质的水溶液为混合物,盐酸是氯化氢气体的水溶液,漂白粉是氯化钙和次氯酸钙的混合物,都是混合物,故D正确;
故选C.
点评 本题考查了物质分类、物质组成、物质名称等,注意知识的积累,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 将AlCl3溶液蒸发结晶提取无水AlCl3 | |
| B. | 在温水瓶中加入Na2CO3溶液浸泡后加入盐酸能除去内壁的CaSO4 | |
| C. | 用饱和的NaOH热溶液除去乙酸乙酯中的乙醇、乙酸 | |
| D. | 用酸性KMnO4溶液除去乙烷中混有的少量乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{18}$O2-离子结构示意图: | B. | HClO的结构式:H-O-Cl | ||
| C. | NF3的比例模型: | D. | H2O2的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际七个基本物理量之一 | |
| B. | 含NA个O原子的O2物质的量为0.5mol | |
| C. | 6.02×1023个任何物质的量均为1mol | |
| D. | 1mol氢含有6.02×1023个氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
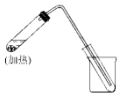 如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同.回答下列问题:
如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
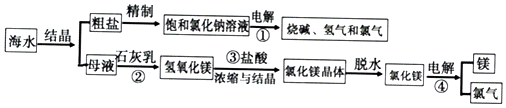
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性a>b | |
| B. | a与b只能形成两种化合物:ab和ab2 | |
| C. | c和其他3种元素均能形成离子化合物 | |
| D. | d与a元素能形成离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com