
 CO2↑+4NO2↑+2H2O.
CO2↑+4NO2↑+2H2O. CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
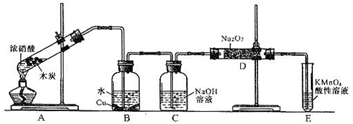
(12分)某化学兴趣小组以碳和浓硝酸为起始原料,想利用一氯化氮与过氧化钠反应制备亚硝酸钠。设计装置如下:(忽略装置中空气的影响)
请回答下列问题:
(1)装置A的试管中发生反应的化学方程式是 。
(2)猜测B中可以观察的主要现象是
。C瓶出来的气体是 。
(3)已知:①室温下存在反应3HNO2=HNO3+2NO↑+H2;②在酸性溶液中,NO![]() 可将MnO
可将MnO![]() 还原为Mn2+且无气体生成。写出检验D中产物是亚硝酸钠的方法:
还原为Mn2+且无气体生成。写出检验D中产物是亚硝酸钠的方法:
。
(4)E装置的作用是 。
(5)同学们经过讨论认为上述装置仍有缺陷,为避免D管中生成NaOH,你认为应该进行的改进是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省吉安市高三上学期期末教学质量评价化学试卷(解析版) 题型:实验题
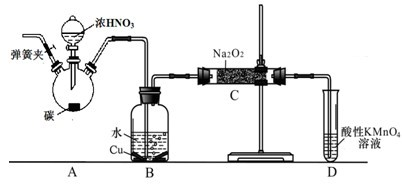
亚硝酸钠广泛用于印染、漂白等行业,在建筑行业用作防冻剂,在食品工业作防腐剂和增色剂,它是一种潜在致癌物质,过量或长期食用对人产生危害,由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生被当食盐误食的事件。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置,利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验),
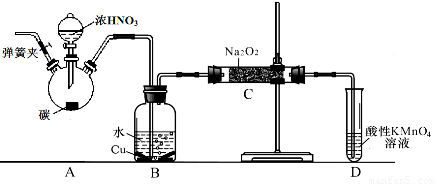
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②NO2-能被很多常见的强氧化剂氧化,如在酸性溶液中可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
④HNO2在酸性溶液也是一种氧化剂,如能把I-氧化成I2。
⑤AgNO2是一种难溶于水易溶于酸的白色化合物。
(1)写出C中制备亚硝酸钠反应的化学方程式(反应物的物质的量之比为2:1)??????? 。
(2)D装置的作用是??????? 。
(3)经检验C产物中亚硝酸钠含量较少。甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。为排除干扰甲同学在B、C装置间增加装置E,E中盛放的试剂应是________(写名称)。
(4)人体正常的血红蛋白中含Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是?????? 。
A.亚硝酸盐是还原剂????????????? ????????????? ????????????? ? B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+????????????? ????????????? ????????????? ? D.亚硝酸盐被还原
(5)能用来鉴别NaNO2和NaCl的方法是?????????
A .测溶液pH法
B.加酸法
C.AgNO3和HNO3两种试剂法??
D.加KI淀粉(酸性)法
E.以上四种方法都可
(6)某同学把溴水加到NaNO2溶液观察到溴水褪色,请写出此反应的离子方程式??????????????????????????????????????????? 。
查看答案和解析>>
科目:高中化学 来源:北京市石景山区2010年高三一模(理科综合)化学部分 题型:填空题
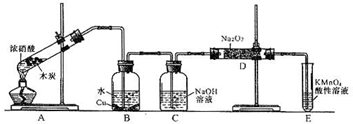
(12分)某化学兴趣小组以碳和浓硝酸为起始原料,想利用一氯化氮与过氧化钠反应制备亚硝酸钠。设计装置如下:(忽略装置中空气的影响)
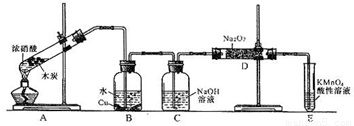
请回答下列问题:
(1)装置A的试管中发生反应的化学方程式是 。
(2)猜测B中可以观察的主要现象是
。C瓶出来的气体是 。
(3)已知:①室温下存在反应3HNO2=HNO3+2NO↑+H2;②在酸性溶液中,NO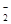 可将MnO
可将MnO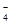 还原为Mn2+且无气体生成。写出检验D中产物是亚硝酸钠的方法:
还原为Mn2+且无气体生成。写出检验D中产物是亚硝酸钠的方法:
。
(4)E装置的作用是 。
(5)同学们经过讨论认为上述装置仍有缺陷,为避免D管中生成NaOH,你认为应该进行的改进是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com