
【题目】X元素的阳离子和Y元素的阴离子具有相同的电子层结构,下列叙述正确的是( )
A.原子序数:X<YB.原子半径:X<YC.离子半径:X>YD.电负性:X<Y
科目:高中化学 来源: 题型:
【题目】向含Fe2+、I﹣、Br﹣的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b﹣a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )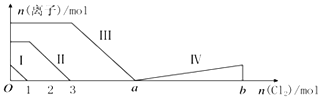
A.线段Ⅱ表示Br﹣的变化情况
B.线段Ⅳ表示IO3﹣的变化情况,其中IO3﹣增加了5moL.
C.a=6
D.原溶液中n(FeI2):n(FeBr2)=3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJmol﹣1 .
请回答下列问题:
(1)图中A、C分别表示、 , E的大小对该反应的反应热有无影响? . 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? , 理由是;
(2)图中△H=kJmol﹣1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化.写出该催化循环机理的化学方程式;
(4)如果反应速率υ(SO2)为0.05molL﹣1min﹣1 , 则υ(O2)=molL﹣1min﹣1、υ(SO3)=molL﹣1min﹣1;
(5)已知单质硫的燃烧热为296kJmol﹣1 , 计算由S(s)生成3molSO3(g)的△H(要求计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组在实验室模拟工业“侯氏制碱法”原理制取NaHCO3 . 下图是该学习小组进行模拟实验时所用到的主要装置. 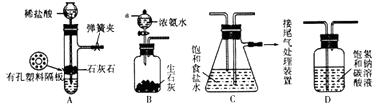
请回答下列问题:
(1)B装置中仪器a的名称是 .
(2)C装置中发生的现象是 , 反应的化学方程式是
(3)检验A装置气密性的方法是:塞紧带长颈漏斗的橡胶塞,夹紧弹簧夹后,向漏斗里注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,若 . 说明装置不漏气.
(4)D是连接在装置A与装置C之间的气体净化装置,装置D的作用是 .
(5)实验时向饱和NaCl溶液中先通入NH3 , 再通入CO2的原因是 .
(6)设计实验方案,检验NaHCO3产品中是否含有氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是从铝士矿(主要成分为Al2O3 , 还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程: 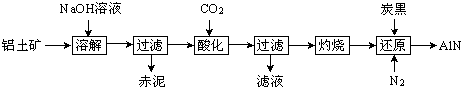
(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH 赤泥的主要成分为(写出化学式).
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3 , 滤液的主要成分为(写出化学式).实验室过滤需用到的玻璃仪器有烧杯、、玻璃棒.
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为 .
(4)现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如表所示. (已知:AlN+NaOH+H2O═NaAlO2+NH3↑)
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
①该样品中AlN的质量分数为多少?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,下表为四种金属的熔、沸点:
Na | Cu | Al | Fe | |
熔点/℃ | 97.5 | 1083 | 660 | 1535 |
沸点/℃ | 883 | 2595 | 2200 | 3000 |
根据以上数据判断其中不能形成合金的是( )
A. Cu和NaB. Fe和Cu
C. Fe和AlD. Al和Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.实验室用加热NH4Cl固体的方法制备NH3
B.用点燃的火柴在液化气钢瓶口检验是否漏气
C.工业上用SO2漂白纸浆、毛、丝、草帽辫等
D.保存金属钠的仓库着火可以用二氧化碳灭火器去灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)26H2O]是分析化学中的重要试剂.摩尔盐隔绝空气加热可完全分解生成红棕色固体和其他产物.某学习小组欲探究其分解产物.
(1)甲组同学设计了如图1所示实验装置. 
(i)实验中,装置B中观察到的现象是 .
(ii)碱石灰的主要作用是 .
(iii)装置D中观察到酚酞溶液变红色,由此可知摩尔盐分解的产物中有(写化学式).
(iv)设计实验验证装置A中固体残留物不含FeO:(简要说明实验操作、现象和结论).
(2)乙组同学认为摩尔盐受热分解的产物中还含有SO2、SO3和N2 . 为进行验证,用甲组实验中的装置A和下列如图2所示装置进行实验.
说明此固体产物不含FeO|多余
(i)乙组同学的实验装置中,依次连接的合理顺序为A、 . 装置G中盐酸的作用是
(ii)实验中,准确称量摩尔盐7.8400g,充分加热反应后,测得装置A中固体残留物的质量为1.6000g,装置G中生成白色沉淀的质量为3.4950g,装置H中收集到112mL N2(标准状况下),写出摩尔盐受热分解的化学方程式: . (分解产物被充分吸收,不考虑其损失)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com