
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4(1) △H1= -195kJ·mol-1
②N2H4(1) + O2(g)= N2(g) + 2H2O △H2= -534.2kJ·mol-1
写出肼和N2H4反应的热化学方程式 ;
(3)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
(1)5
(2)2NH3+NaClO=N2H4+NaCl+H2O
(3)2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=—873.4kJ/mol
(4)N2H4+4OH--4e-=N2+4H2O
【解析】
(1)N原子的核外电子排布式为1s22s22p3,所以氮元素原子的L层电子数为5,故答案为:5;(2)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,故答案为:2NH3+NaClO=N2H4+NaCl+H2O;(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气,将方程式②×2-①得肼和N2O4 反应的热化学方程式,2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol,故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;(4)肼一空气燃料碱性电池中,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N2H4+4OH--4e-=4H2O+N2,故答案为:N2H4+4OH--4e-=N2+4H2O


科目:高中化学 来源:2014高考名师推荐化学制备实验方案的设计与评价(解析版) 题型:实验题
下列实验方案正确且能达到相应实验预期目的的是
|
|
|
|
A.制取少量蒸馏水 | B.制取少量NO2 | C.比较MnO2、Cl2、I2的氧化性 | D.探究NH4HCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学乙醇和乙酸(解析版) 题型:选择题
下列说法正确的是

A.实验室常用如上图所示的装置制取少量的乙酸乙酯
B.可用点燃的方法鉴别甲烷和乙烯
C.糖类、蛋白质、油脂属于天然有机高分子化合物
D.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学Vm与它的推论应用(解析版) 题型:选择题
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是
A.体积相等时密度相等
B.原子数相等时具有的中子数相等
C.体积相等时具有的电子数相等
D.质量相等时具有的质子数相等
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学NA与粒子(解析版) 题型:选择题
设NA为阿伏加德罗常数,如果a g某气态双原子分子的分子数为p,则b g该气体在标准状况下的体积V(L)是
A  B
B 
C  D
D 
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学Ksp的计算及有关图像的分析(解析版) 题型:填空题
(1)①25 ℃时,将20 mL 0.1 mol·L-1CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示。反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。

反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”“<”或“=”)。
②若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)。
A.c(CH3COO-) B.c(H+) C.KW D.醋酸电离平衡常数
E.
(2)下图为某温度下,PbS(s).ZnS(s).FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度.金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+.Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。

(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10 mL 0.01 mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ,c(H2C2O4) c(C2 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学CB计算法(解析版) 题型:选择题
实验室里需用480 mL 0.10 mol·L-1 CuSO4溶液,现选用500 mL容量瓶进行配制,以下操作正确的是
A.称取7.68 g硫酸铜,加入500 mL水
B.称取12.0 g胆矾配制500 mL溶液
C.称取8.0 g硫酸铜,加入500 mL水
D.称取12.5 g 胆矾配制500 mL溶液
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
用选项中的电极、溶液和如图所示装置可组成原电池。下列现象或结论叙述正确的是
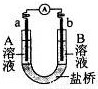
选项 | 电极a | 电极b | A溶液 | B溶液 | 现象或结论 |
A | Cu | Zn | CuSO4 | ZnSO4 | 一段时间后,a增加的质量与b减少的质量相等 |
B | Cu | Zn | 稀H2SO4 | ZnSO4 | 盐桥中阳离子向b极移动 |
C | C | C | FeCl3 | KI、淀粉混 合液 | b极附近溶液变蓝 |
D | Fe | C | NaCl | FeCl3 | 外电路电子转移方向:b→a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com