
| A. | 能使甲基橙变红的溶液中:Fe2+、Al3+、NO3-、Cl-、S2- | |
| B. | 在pH=11的溶液中:Na+、AlO2-、NO3-、S2-、SO32- | |
| C. | 室温下,由水电离的c(H+)=10-10mol/L的溶液中:Cl-、HCO3-、NO3-、NH4+、F- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:K+、Na+、AlO2-、SCN- |
分析 A.能使甲基橙变红的溶液,显酸性;
B.pH=11的溶液,显碱性;
C.室温下,由水电离的c(H+)=10-10mol/L的溶液,为酸或碱溶液;
D.离子之间结合生成络离子,离子之间相互促进水解.
解答 解:A.能使甲基橙变红的溶液,显酸性,不能大量存在S2-,且S2-、Al3+相互促进水解,S2-或Fe2+、H+、NO3-发生氧化还原反应,不能共存,故A错误;
B.pH=11的溶液,显碱性,该组离子之间不反应,可大量共存,故B正确;
C.室温下,由水电离的c(H+)=10-10mol/L的溶液,为酸或碱溶液,酸溶液中不能大量存在HCO3-、F-,碱溶液中不能大量存在HCO3-、NH4+,故C错误;
D.Fe3+、SCN-结合生成络离子,Fe3+、AlO2-相互促进水解,不能共存,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重水解反应、氧化还原反应的离子共存考查,综合性较强,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
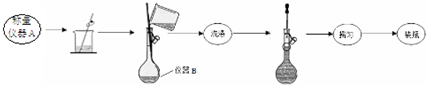
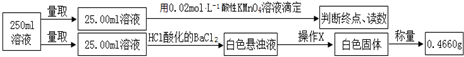
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
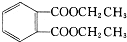 )是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:
)是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法: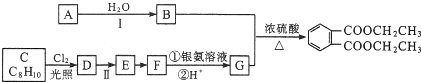
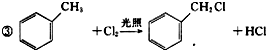
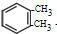 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$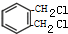 +2HCl.
+2HCl. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 mL容量瓶,58.5 gNaCl | B. | 500 mL容量瓶,117 g NaCl | ||
| C. | 1 000 mL容量瓶,58.5 g NaCl | D. | 1 000 mL容量瓶,117 g NaC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中的两层液体均从下口放出 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 称量NaOH固体时,将NaOH固体放在托盘天平左盘的纸上 | |
| D. | 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
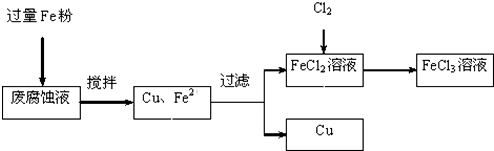
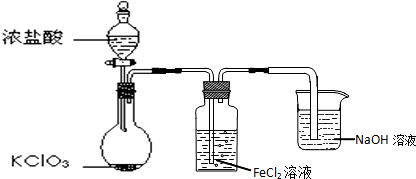
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1的KNO3溶液中:H+、Fe2+、Cl-、SO42- | |
| B. | c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、ClO- | |
| C. | 能使pH试纸变红的溶液中:K+、Ba2+、AlO2-、Cl- | |
| D. | pH=0的溶液中:Mg2+、Na+、F-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 实验目的 |
| A | 沿玻璃棒将蒸馏水缓慢倒入盛有浓硫酸的烧杯中,边加边搅拌 | 稀释浓硫酸 |
| B | 测定相同浓度的Na2SO4和Na2SiO3溶液的pH值 | 比较硫和硅的非金属性强弱 |
| C | 将铁的氧化物溶于过量稀盐酸中,再滴加几滴紫红色KMnO4溶液 | 判断某铁的氧化物是否含有Fe2+ |
| D | 用装有双氧水的碱式滴定管,采用淀粉溶液作为指示剂,滴定NaCl和NaI混合溶液 | 测定NaI的含量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com