
| A. | ④⑤⑥ | B. | ①③⑤ | C. | ②④⑥ | D. | ②③⑤⑥ |
分析 电离方程式的书写应遵循质量守恒定律,即左右两边同种元素的原子个数相等;同时溶液不显电性的原因是阳离子所带的正电总数和阴离子所带的负电总数相等.离子带电数和元素或原子团所显的化合价数值相等.且要注意共价键在熔融状态不能被破坏,对于酸式弱酸根,在水溶液中不能完全电离,不能拆,据此分析.
解答 解:①在水溶液中,由于HSO4-是酸式的强酸根,故必须拆,故正确的电离方程式为:NaHSO4=Na++H++SO42-;故①错误;
②熔融状态下,共价键不能被破坏,即HSO4-不能拆,故电离方程式为:NaHSO4=Na++HSO4-,故②正确;
③水溶液中由于HCO3-是酸式弱酸根,不能完全电离,故不能拆,故电离方程式为:NaHCO3=Na++HCO3-,故③正确;
④由于磷酸为多元中强酸,电离方程式应分步写,故④错误;
⑤H2S为二元弱酸,在水溶液的电离步完全,且应分步进行,故电离方程式为:H2S+H2O?H3O++HS-,故⑤正确;
⑥HF为弱酸,在水溶液中电离不完全,用可逆号,即 HF+H2O?H3O++F-.故⑥正确.
故选D.
点评 电离方程式的书写应遵循质量守恒定律,即左右两边同种元素的原子个数相等;同时溶液不显电性的原因是阳离子所带的正电总数和阴离子所带的负电总数相等.


科目:高中化学 来源: 题型:解答题
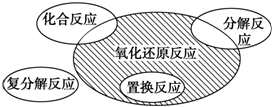 氧化还原反应和离子反应是中学化学中重要的反应类型.回答下列问题:
氧化还原反应和离子反应是中学化学中重要的反应类型.回答下列问题: =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钇在周期表中的位置是第4周期ⅢB族 | |
| B. | 属于非金属元素 | |
| C. | 质子数与中子数之差为50 | |
| D. | 89Y和90Y是两种不同的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.00mol•L-1NaCl溶液中含有Na+的数目为NA | |
| B. | 常压下常温,6.4g由氧气和臭氧组成的混合物中含有的分子总数为0.2NA | |
| C. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| D. | 7.8g过氧化钠含有的共用电子对数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与H2SO4溶液 | B. | Fe与FeCl3溶液 | C. | Fe与HCl溶液 | D. | Fe与CuSO4 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
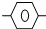 CH2-CH=CHCH3的说法正确的是( )
CH2-CH=CHCH3的说法正确的是( )| A. | 所有C原子可能共平面 | B. | 除苯环外的C原子共直线 | ||
| C. | 最多只有10个C共平面 | D. | 最多只有4个C共直线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Ag+)•c(Cl-)增大 | B. | c(Ag+)•c(Cl-)不变 | C. | c(Ag+)、c(Cl-)均不变 | D. | c(Ag+)、c(Cl-)均减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com